이번 포스트에서는 펩티도글리칸(peptidoglycan)과 라이소자임(lysozyme)에 대해 알아보자.
peptidoglycan은 bacteria에서 단단한 cell wall을 만드는 주성분이라 할 수 있음. 이 때 이 peptidoglycan을 끊어줄 수 있는 녀석이 바로 lysozyme임. 그런데 peptidoglycan이 끊어지게 되면 bacterial cell wall의 구조가 제대로 유지되지 못하고 그 결과 bacteria의 lysis가 일어날 수 있음. 따라서 이러한 lysozyme은 주로 antibacterial enzyme으로 기능함.

위 그림은 peptidoglycan 중 polysaccharide 구조를 보여주고 있음. 보면 이 경우 GlcNAc와 Mur2Ac가 번갈아가면서 연결된 구조가 관찰됨. 이 중에서 GlcNAc와 Mur2Ac를 끊어주는 hydrolysis 반응을 lysozyme이 촉매할 수 있음.
lysozyme의 구조는 위 그림 왼쪽 아래와 같음. 이 때 이 구조를 보면 Asp52는 nucleophile로 기능하고 Glu35는 general acid로 기능하게 됨.

위 그림은 SN1과 SN2 reaction을 각각 나타내주고 있음. 보면 SN1 reaction은 보는 바와 같이 물질이 하나 먼저 떨어져 나간 다음에 그 후 다른 물질이 들어가는 것을 말하고 SN2 reaction은 물질의 들락날락이 동시에 일어나는 반응을 말함.


실제로 초창기에는 enolase가 위와 같이 SN1, SN2 중 어느 경로를 거치는지에 대해 잘 몰랐었음. 이 때 SN1 reaction을 보면 Mur2Ac 자체의 O가 스스로를 activate시켜서 그 결과 Glu의 도움을 밭아 carbocation intermediate가 형성되게 됨. 한편 SN2 reaction의 경우에는 처음부터 효소 내의 Asp가 Mur2Ac의 C를 공격한 결과 enzyme-substrate간에 covalent bond로 연결된 intermediate가 형성되게 됨.
그런데 이 중 실제로 실험 결과 관찰된 것이 covalent intermediate였음. 따라서 SN2 reaction이 enolase reaction에서 더 dominant한 것처럼 보임.
이후 SN2 reaction에서는 형성된 covalent intermediate가 깨지는 과정에서 물이 들어가게 되고 이후 Glu가 물에 작용하게 되면서 intermediate가 깨지게 됨. 그 결과 cleavage된 substrate가 release되게 됨.

한편 실제로 Glu를 glutamine으로 바꿀 시 covalent intermediate는 형성되지만, 이후 반응이 일어나지 않게 됨. 결과적으로 이 mutant enolase를 이용해 구조생물학적으로 구조를 관찰할 시 covalent intermediate 구조가 실제로 관찰되게 됨. 이를 통해 실제로 이 녀석의 반응은 주로 SN2로 일어난다는 것을 알 수 있었음.

위 그림에서 나타나 있는 것과 같이 bacteria가 가지는 peptidoglycan 내부에는 D amino acid가 일부 관찰됨. 이런 amino acid들이 peptide의 일부를 이루고 있기 때문에 생체 내 protease들은 이들을 제대로 분해하지 못하게 되고 그 결과 peptideoglycan은 생체 내 protease에 대해 resistance를 가지게 됨.
한편 이 peptidoglycan의 경우 위 그림 아래와 같이 cross-link를 형성할 수 있음. 이런 cross-link를 형성하게 되면 그 결과 cell wall 구조가 rigid해짐. 이 때 cross-link 형성에 관여하는 효소가 바로 transpeptidase임.
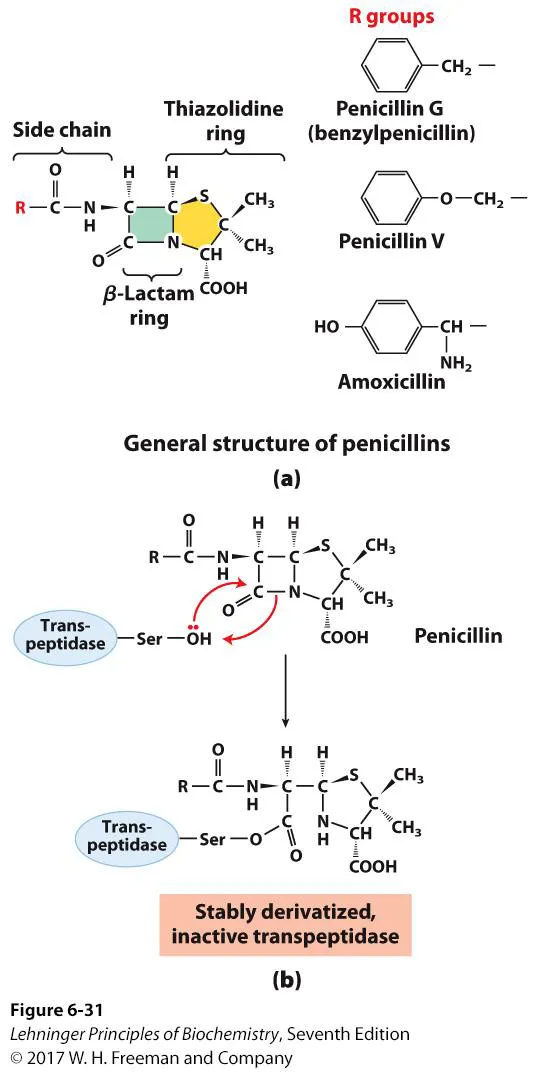
이 때 이 transpeptidase의 활성을 저해해 peptidoglycan의 cross-linkage를 막고 외부 스트레스에 bacteria가 더 vulnerable해지게 만들어주는 항생제가 바로 Penicillin임. Penicillin의 구조는 위 그림 가운데와 같음. 이 때 transpeptidase의 Ser residue와 irreversible한 covalent bond를 형성해서 transpeptidase를 inhibit시켜주는 Penicillin의 핵심부위가 바로 β-lactam ring임. 그렇기에 이 Penicillin을 β-lactam 계열의 항셍제라고 함.
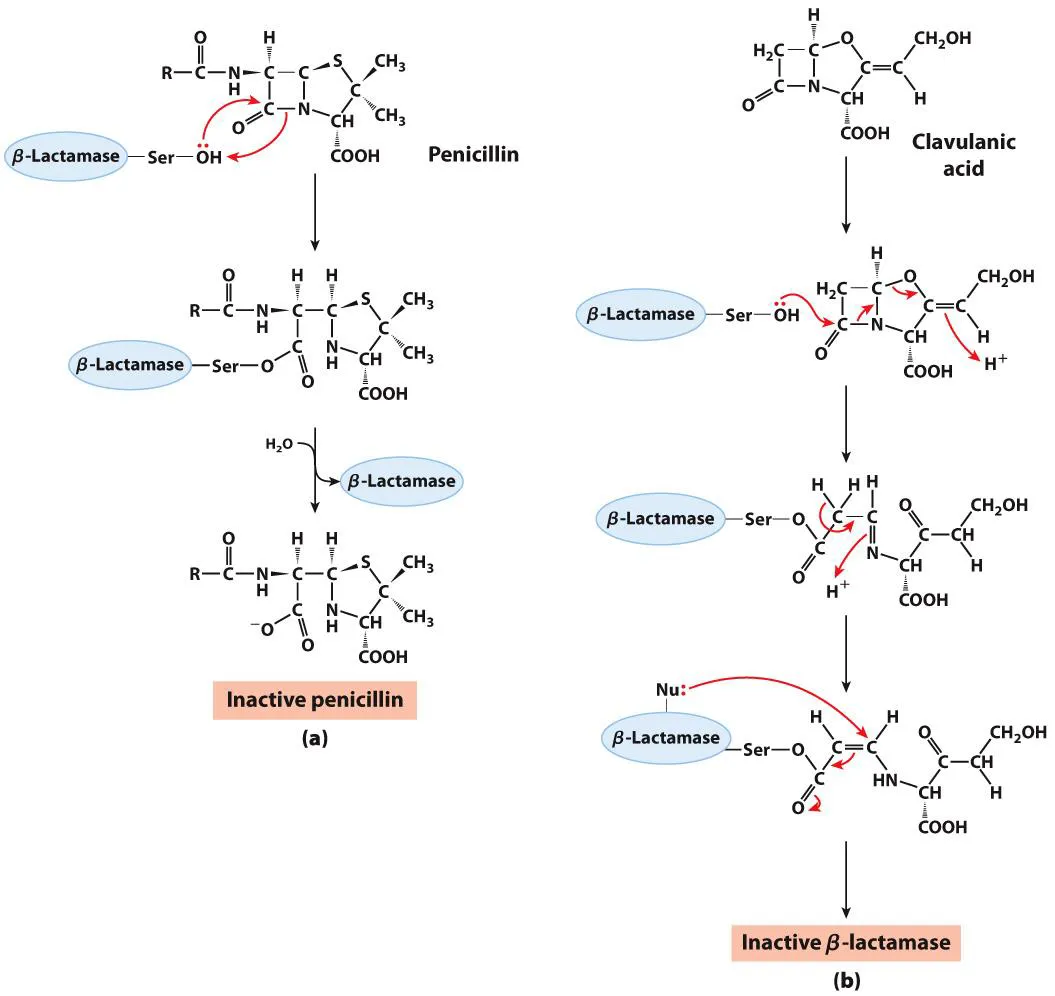
그런데 일부 bacteria들의 경우 Penicillin에 저항성을 가지는 경우가 있음. 그 경우가 위 그림 왼쪽과 같음. 보면 이 녀석들의 경우에는 β-lactamase를 가지고 있음. 이 효소는 보는 바와 같이 penicillin의 β-lactam ring을 잘라버려서 이 녀석이 제대로 transpeptidase를 inhibit하지 못하게 해버림.
이런 항생제 저항성을 가진 bacteria에게 사용가능한 해결책이 또 존재하는데, 바로 Clavulanic acid임. 이 녀석은 위 그림 오른쪽에 나타나 있는 것처럼 β-lactamase를 inhibit하게 됨. (구체적으로는 β-lactamase의 Ser residue를 targeting해서 inhibition시키게 됨) 그 결과 β-lactamase를 inhibit하게 되고, 결과적으로 이 녀석과 penicillin을 같이 처리할 시 Penicillin 저항성이 있는 bacteria도 효과적으로 죽일 수 있음.
다음 포스트에서는 enzyme의 kinetics에 대해 알아보자.
'전공자를 위한 생물학 > 생화학' 카테고리의 다른 글
| [생화학] 5.5 : 효소의 kinetics - 2 (0) | 2024.11.07 |
|---|---|
| [생화학] 5.5 : 효소의 kinetics - 1 (0) | 2024.11.07 |
| [생화학] 5.3 : HIV protease, hexokinase, enolase (0) | 2024.11.07 |
| [생화학] 5.2 : 카이모트립신(chymotrypsin) (0) | 2024.11.07 |
| [생화학] 5.1 : 효소(enzyme)의 특징 - 3 (0) | 2024.11.07 |