이번 포스트부터는 enzyme kinetics에 대해 알아보자.
kinetics를 본다는 것은 reaction rate을 본다는 것임.
이 때의 enzymatic reaction rate은 enzyme 자체, substrate, effector, temperature에 의해 영향을 받을 수 있음.

enzyme kinetics 관련 선구자적인 연구를 하신 분들이 Michaelis와 Menten임.
이러한 kinetics 연구를 통해 biocatalysis에 대한 정량적인 정보를 얻을 수 있고 mechanism을 알 수 있으며, enzyme을 더 좋게 만들어주는 연구도 할 수 있고, effective한 inhibitor도 만들 수 있으며 activity regulation에 대해서도 중요한 정보를 얻을 수 있음.
이제 아래와 같은 반응을 생각해보자.

일단 이 때 자명하게 아래 관계가 성립함. (이 때 E+P가 다시 ES로 가지 않는다고 가정함. 물론 E+P가 ES로 다시 돌아가는 enzyme도 있는데 이 경우 지금부터의 논의로는 설명이 제대로 되지 않을 것임)

한편 아래와 같은 assumption도 성립한다고 가정하자.
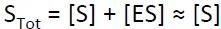
이런 assumption은 substrate가 아직 product로 많이 바뀌지 않았을 때, substrate가 enzyme에 비해 충분히 많이 제공되었을 때 잘 성립함. 즉, 이 assumption을 한다는 것은 주로 반응이 시작된지 오래되지 않은 상태에서의 equation을 만든다는 의미라고도 볼 수 있음. (그렇다 보니 앞으로 유도할 equation은 반응이 어느정도 진행되었을 때의 상황을 묘사해주지는 못함)
그리고 또 하나의 중요한 assumption이 steady state assumption임. 이는 단순한데, ES의 생성, 소멸양이 거의 비슷하다는 것임.

결국 위 수식에서 ES formation과 ES breakdown의 양이 동일해지게 됨. (이 경우에도 반응 초반에서만 성립하는 이야기임)

그리고 위와 같이 초기의 반응속도, 즉 initial velocity V0는 k2[ES]와 같음. (ES→E+P가 rate limiting step이기 때문)
이제 본격적으로 Michaelis-Menten equation(미카엘리스-멘텐 식)을 유도해보자.
효소 반응의 완전 초반에는 E와 S가 많으므로 활발히 ES가 생성되는 presteady state가 될 것임. 그런데 이 시기가 지나고 나면 ES의 농도가 일정한 steady state가 오게 됨.

이 때는 ES의 생성속도와 ES의 분해속도가 똑같을 것임. 이 관계를 이용해서 수식을 유도하고자 함.
ES가 생성되는 속도, ES가 분해되는 속도를 rate constant들을 이용해서 각각 표현하면 아래와 같이 나타낼 수 있음.

그리고 이 때 각각의 속도가 같다는 관계식을 세우게 되면 결과적으로 위 그림 맨 아래와 같이 등식을 세울 수 있음.
그리고 이 등식의 좌변을 농도에 관련된 항으로만, 우변을 rate constant에 관련된 항으로만 정리하면 결과적으로 아래와 같은 식을 얻게 됨.

결국 이 값이 Km, 즉 Michaelis and Menten constant로 정의됨.
그러면 도대체 Km은 무슨 의미를 가지는 것일까.
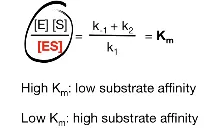
식에 따르면 Km이 크다는 것은 ES의 농도에 비해 E, S 각각의 농도가 더 크다는 것임. 이 말인즉슨 enzyme과 substrate간의 affinity가 크게 높지 않아서 ES가 비교적 unstable하다는 것을 의미함. 한편 Km이 작다는 것은 ES의 농도가 E, S 각각의 농도에 비해 더 크다는 것임. 이 말인즉슨 enzyme과 substrate간의 affinity가 높아서 ES가 비교적 stable하다는 것을 의미함.
그런데 사실 이러한 affinity 관련 추측은 특별히 k2가 매우 작을 때, 즉 ES→P+E의 반응이 rate limiting step일 때만 성립하는 이야기임.
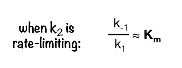
그 이유는 k2가 무시할 수 있을 정도로 작을 때만 비로소 Km이 위와 같이 근사될 수 있기 때문임.
다음 포스트에서 이어서 살펴보자.
'전공자를 위한 생물학 > 생화학' 카테고리의 다른 글
| [생화학] 5.5 : 효소의 kinetics - 3 (0) | 2024.11.07 |
|---|---|
| [생화학] 5.5 : 효소의 kinetics - 2 (0) | 2024.11.07 |
| [생화학] 5.4 : 펩티도글리칸과 라이소자임(peptidoglycan and lysozyme) (0) | 2024.11.07 |
| [생화학] 5.3 : HIV protease, hexokinase, enolase (0) | 2024.11.07 |
| [생화학] 5.2 : 카이모트립신(chymotrypsin) (0) | 2024.11.07 |