이번 포스트에서는 HIV protease, hexokinase, 그리고 enolase에 대해 알아보자.
HIV protease는 aspartic acid protease의 일종임. HIV virus는 human immunodeficiency virus임. 최근에는 매우 좋은 drug들이 잘 개발되어서 거의 HIV infection에 의한 disease가 극복되었다고 봐도 무방함.
HIV protease는 HIV(kind of RNA virus or retrovirus)에 작용함. 이 때 보통 HIV의 genome은 한번에 다 translation되고 그 결과 polyprotein이 먼저 만들어짐. 그런데 이들은 여러 protein들이 연결된 상태이므로 그 자체로는 activity가 없음. 이 때 이들은 inactive하며, 이 녀석들을 적절한 크기로 잘라줘서 activate시켜주는 녀석 중 하나가 바로 HIV protease임. 따라서 이 HIV protease를 inhibition하는 방식은 HIV에 의한 disease를 cure하는 하나의 전략이 될 수 있음.
이와 관련해 등장하는 개념이 바로 mechanism of action(MOA)임. MOA는 특정한 drug들이 어떻게 역할을 하게 되는지의 mechanism을 의미함.

위 그림에는 HIV protease의 작동 mechanism이 나타나 있음. 보면 이들의 경우 active site에 두 개의 Asp residue가 존재함. 이 때 O-를 끝에 가지고 있는 Asp가 좋은 base로 작용하게 됨. 한편 이 반응에 동시에 첨가된 물과 substrate의 경우 한 step에서 reaction이 일어나게 됨. 보면 물이 우선 base 역할을 하는 Asp에게 H를 빼앗기고 그 결과 O가 더욱 nucleophilic해짐. 이렇게 nucleophilic해진 O는 substrate의 carbonyl C를 공격하게 됨. 그 결과 위 그림 가운데에 있는 tetrahedral intermediate가 만들어짐. (이 때 이 경우 enzyme과 substrate간의 covalent intermediate가 만들어지는 것은 아님에 유의) 참고로 이 때 tetrahedral intermediate의 unstable한 O-는 또 다른 Asp에 의해 잠시동안이라도 stabilize될 수 있음. 이후 이 intermediate가 다시금 collapse되면서 위 그림 맨 오른쪽과 같이 substrate가 cleave된 채로 release되게 됨.
이 때 Asp 중 어떤 녀석은 negative charge를 띄고, 어떤 녀석은 neutral하기도 함. 이는 Asp 주변의 environment 때문임. (가만 놔뒀을 때는 - charge가 기본) 즉, neutral Asp의 경우 주변 active site가 이 neutral form의 Asp를 stabilize시켜주기 때문에 이러한 형태로 존재할 수 있는 것임. 사실 이렇기 때문에 또 enzyme이 globular form이어야 하는 것임. (globular해야 이러한 stabilize가 더 쉽게 일어날 수 있을 것임)

실제로 이러한 biochemical mechanism을 이용해서 위와 같이 HIV protease inhibitor를 제작할 수도 있음. 보면 실제로 이 녀석들의 경우 OH(intermediate가 가지고 있는 OH와 similar), 그리고 그 옆에는 aromatic ring이 있다는 것을 알 수 있음.
다음으로 hexokinase에 대해 알아보자.

hexokinase는 위와 같은 reaction을 catalyze하는 enzyme임.
보면 glucose에 ATP로부터 전해진 phosphate가 옮겨붙어서 G6P가 형성됨. 이 때 ATP에 mediate되어있는 녀석이 바로 Mg metal임. Mg는 charge를 가지고 있으므로 ATP 내의 phosphate와 interaction을 쉽게 할 수 있음. 따라서 Mg는 ATP가 작용하는 현상을 쉽게 도와줄 수 있음.

위 그림에 나타나 있는 것과 같이 hexokinase는 substrate와 만나면서 a에서 b로 구조 변화가 이루어짐. 즉, 이 효소는 induced fit의 원리에 따라 작용함.
그런데 hexokinase가 b와 같이 변하기 위해서는 glucose가 일단 enzyme에 binding해야 함. 일단 glucose binding에 의해 집게 구조 변형이 일어나고 나면 ATP hydrolysis가 더 잘되게 됨.

한편 이 때 xylose도 hexokinase에 결합할 수 있으며 앞서 나왔던 구조에서 a→b로의 변형을 촉진하기까지 함. 그러나 이 녀석이 실제로 phosphorylation되지는 않음. 따라서 그 결과 xylose는 그대로 있는 상태에서 ATP만 계속 소모되게 됨. 이를 통해서 앞서 보았던 구조 b가 형성되기만 하면 이 구조에 의해서 ATP hydrolysis가 잘 일어나게끔 변한다는 것을 알 수 있음.
다음으로 enolase에 대해 알아보자.
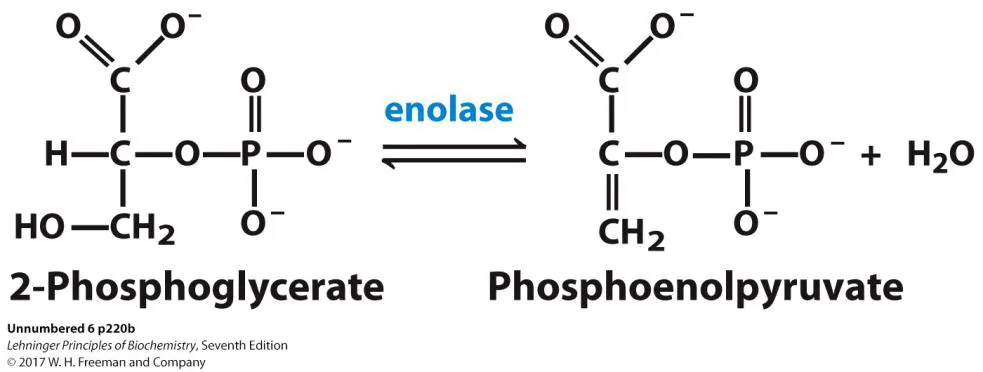
enolase는 위와 같은 reaction을 catalyze하는 enzyme임.
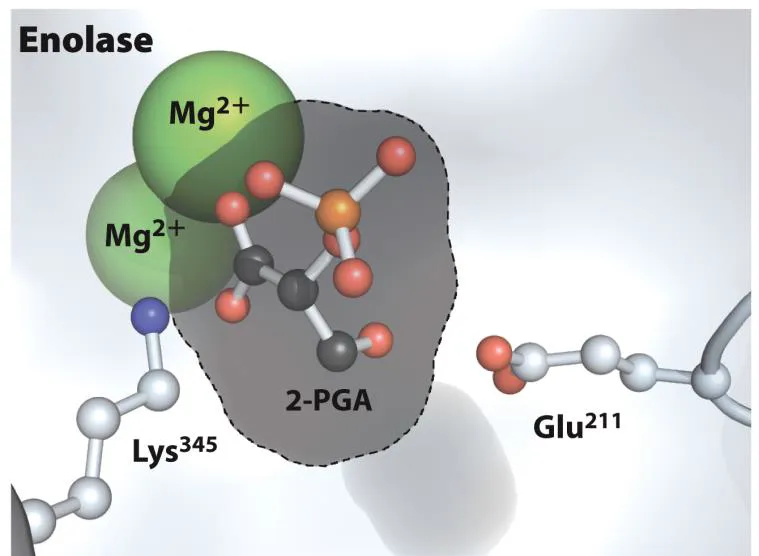
enolase는 위와 같이 2개의 Mg2+가 catalytic site에 존재함.
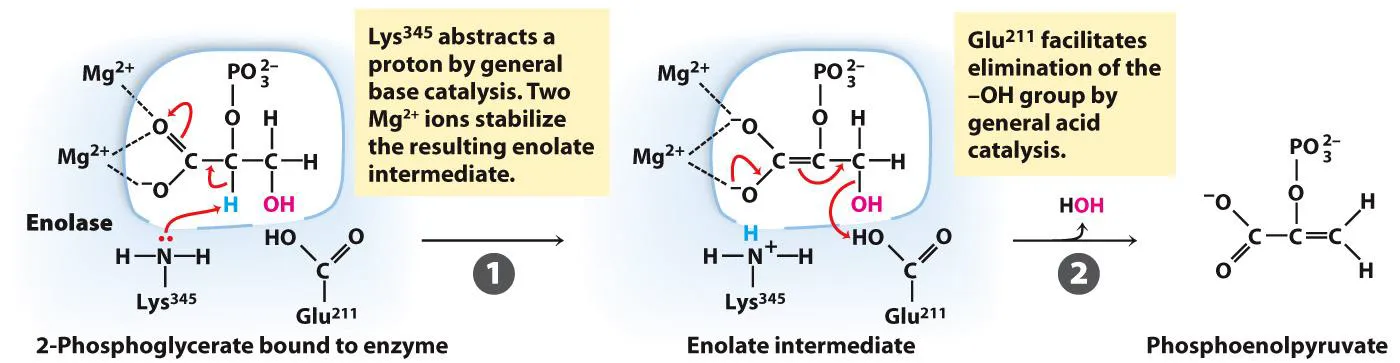
위 그림에는 enolase의 반응 mechanism이 나타나 있음.
이 때도 마찬가지로 Lys이 general base로 작용하게 되고 그 결과 H를 잃어 더 nucleophilic해진 C가 옆쪽 C를 공격하게 되어서 O-가 형성되게 됨. 이 때의 구조를 자세히 보면 O- 두 개가 매우 proximal하게 존재하고 있음. 따라서 원래 이 구조는 매우 불안정함. 그러나 인근의 metal이 이 불안정한 conformation을 안정하게 만들어주는 역할을 함. 이후 이 intermediate가 다시 collapse되는 과정에서 반응이 위 그림 오른쪽과 같이 일어나게 됨. (조금 더 구체적으로는 glutamic acid가 proton을 뺏어서 물이 떨어져나가는 식의 reaction이 일어남)
다음 포스트에서는 peptidoglycan과 lysozyme에 대해 알아보자.
'전공자를 위한 생물학 > 생화학' 카테고리의 다른 글
| [생화학] 5.5 : 효소의 kinetics - 1 (0) | 2024.11.07 |
|---|---|
| [생화학] 5.4 : 펩티도글리칸과 라이소자임(peptidoglycan and lysozyme) (0) | 2024.11.07 |
| [생화학] 5.2 : 카이모트립신(chymotrypsin) (0) | 2024.11.07 |
| [생화학] 5.1 : 효소(enzyme)의 특징 - 3 (0) | 2024.11.07 |
| [생화학] 5.1 : 효소(enzyme)의 특징 - 2 (0) | 2024.11.07 |
