이번 포스트에서는 지난 포스트에 이어서 효소의 특징에 대해 알아보자.
우리 몸에서는 왜 굳이 inorganic catalyst가 아닌 organic catalyst를 써야하는가. 일반적인 경우 inorganic catalyst를 쓰는 경우 반응이 빠르고 효율적으로 일어나는 경우가 많음. 그런데도 불구하고 이런 녀석들이 제대로 기능하게 하기 위해서는 physiological하지 않은, 어찌보면 굉장히 harsh한 condition을 부여해야 함. 따라서 이런 조건은 생체 내에서 구현될 수 없음. 이 때문에 biocatalyst가 생체 내에서 사용되는 것임. 게다가 추가적으로 inorganic catalyst를 쓸 때는 보통 substrate를 한 종류만 넣어주는 경우가 많은데, 생체 내에서는 무수히 많은 biomolecule이 존재하고, 이 중 특정한 녀석에 대해서만 반응을 유발해야 하므로 inorganic catalyst를 쓸 시 side product가 만들어질 위험이 있음.
이런 측면에서 biocatalyst가 훨씬 specificity 측면에서 유리함. 그리고 사실 이 때문에 biocatalyst의 대부분이 globular protein인 것임. (globular해야 specificity가 더 잘 부여될 것이므로) 추가적으로 biocatalyst는 생체 내에서의 timeframe에 적합한 수준에서 반응을 일으키므로 이 또한 장점이라 할 수 있음.

위 그림에는 실제로 매우 reactive해서 이 물질, 저 물질로 변환 가능한 Chorismate라는 물질이, Chorismate mutase가 있을 시 한 product로만 만들어지게 되는 과정을 나타내주고 있음. 그 결과 만들어지는 물질은 tyrosine, phenylalanine 등의 합성에 매우 중요하게 작용함.

특히 enzyme의 이러한 specificity는 stereoisomer까지도 구분함. 위의 경우 phenylalanine hydroxylase가 나타나 있는데, 이 녀석은 맨 위의 L form Phe의 경우 binding이 일어나고 reaction까지 시키지만 중간의 D form Phe의 경우 binding 자체가 일어나지 않음. 그 밖에, 비슷하게는 생겼지만 다른 녀석인 맨 아래 물질의 경우 binding은 일어나지만 reaction은 일어나지 않음.

위 그림에는 실제로 substrate와 enzyme의 active site 내 amino acid들이 interaction을 하면서 결합하는 모습이 나타나 있음. 참고할 것.

enzyme이 없을 때의 경우 위와 같이 S state에서 더 안정한 P state로 가기 위해서는 불안정한 상태인 transition state(이 상태는 아주 위태로움)를 무조건 거쳐야 함. 그리고 이를 위해서는 activation barrier(activation energy) 이상의 에너지가 투입되어야 함. (물론 P→S로의 전환도 가능한데, 이 경우 더 큰 activation barrier를 넘어야 할 것임) 이 때 자연상태에서는 activation barrier가 꽤나 높음.

그런데 enzyme이 있을 시 transition state의 energy를 낮춰주게 되고(즉, activation energy를 낮춰줌), 다시 말해 ES, SP와 같이 비교적 안정적인 intermediate들이 형성되면서 반응이 일어나기 위해 필요한 에너지가 낮아지게 됨. 그 결과 반응의 속도가 빨라짐. 이 때 당연히 S, P state 자체의 에너지는 그대로일 것임.

이 때 반응 속도 rate k를 위와 같은 식으로 나타낼 수 있으므로 참고할 것.

위 표에는 각종 효소들이 반응들을 얼마나 빠르게 만들어줄 수 있는지에 대해 나타나 있음.
enzyme이 activation energy를 낮춰줄 수 있는 것은 binding energy 덕분임. 일반적인 경우 특정 substrate는 자기 혼자서 둥둥 떠다닐 때 훨씬 무질서하므로 entropy 측면에서는 이 상태가 더 favorable할 것임. 그런데 enzyme과 binding을 하게 되면 entropy 측면에서는 이게 unfavorable함. 다만 enzyme은 이를 상쇄하기 위해 각종 weak interaction을 하면서 enthalpy 측면에서 favorable하게 만들고 그 결과 enzyme-substrate, 혹은 enzyme-transition state의 intermediate가 형성됨. 그러고 나면 product가 더 쉽게 만들어질 수 있는 것임.
그 밖에 enzyme은 단순히 특정 반응을 일으키는 두 개의 subunit들 중 reactive한 group끼리를 가깝게 배향해주는, close proximity를 부여해주는 역할도 함. 실제로 이런 역할만으로도 반응이 쉽게 일어날 수 있게 됨.
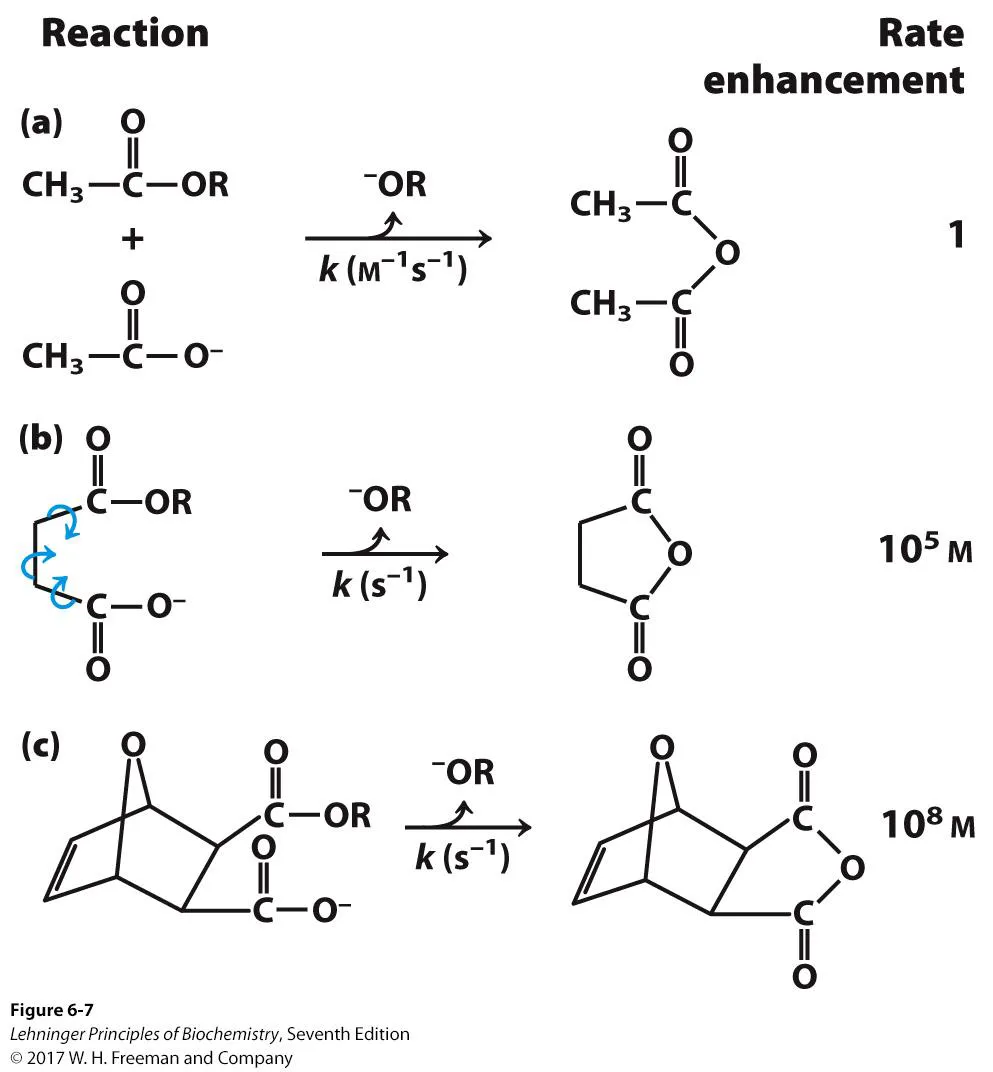
이러한 proximity model을 증명한 실험이 위와 같음.
a의 위는 ester group, 아래는 carboxylic acid인데, 이 둘이 interaction할 시 anhyde가 만들어짐. 이 때 이 둘을 따로따로 처리할 때는 rate이 크게 빠르지 않음. 그래서 사람들이 b와 같이 이 두 substrate를 인위적으로 붙여줘봄. 그랬더니 rate이 엄청나게 증가한 것을 관찰함. 한편 b의 경우에도 bond가 되어있기는 하지만 fluctuation이 심함. 따라서 c와 같이 아예 rigid한 bond를 만들어줘서 ester와 carboxylic acid가 비슷한 위치에 있게 해줌. 그랬더니 b보다도 반응이 더 빨라진다는 것을 확인함.
이를 통해 많은 경우에 proximity만 부여되더라도 반응이 더 빨리 나타나는 경향이 있음을 확인함.
이 밖에 transition state에 binding하는 enzyme도 있음.
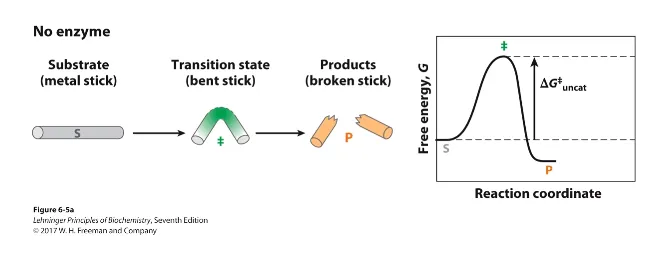
우선 위와 같은 반응을 생각해보자. 보면 S가 transition state가 된 뒤 뚝 잘리면서 P가 형성됨.
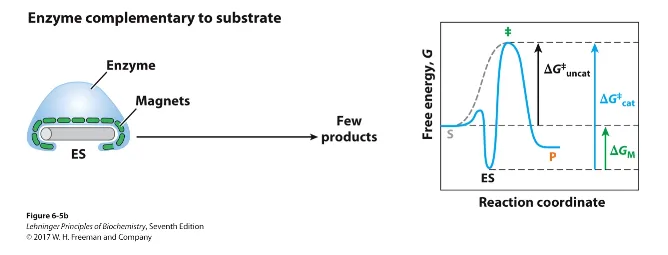
한편 아예 위와 같이 substrate 자체와 완전 tight하게 결합하는 경우, 이 때는 ES complex가 너무 안정해져서 오히려 activation energy가 더 커져버리게 됨.
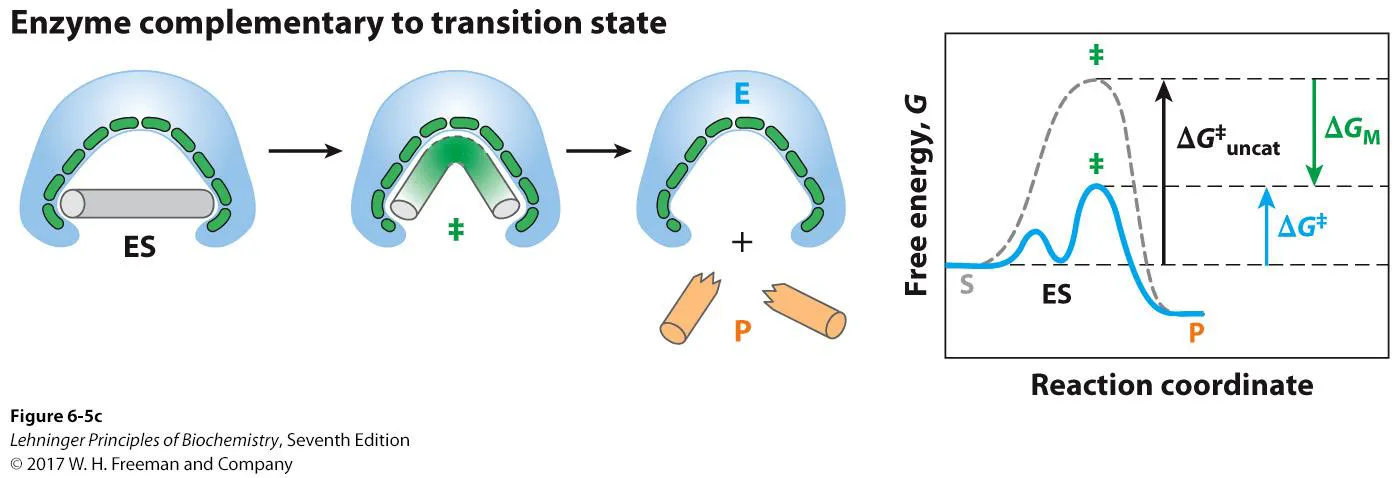
그런데 substrate와 interaction은 적당히만 가지고(적당히는 가져야 ES가 형성될 것) 이후 이 녀석 내부에서 S가 transition state가 되면 이 transition state와 enzyme이 딱 fit하게 되는 경우에는 transition state의 energy 자체가 낮아지게 되면서 위 그림 오른쪽 graph와 같이 activation energy가 낮아지게 됨.
다음 포스트에서 이어서 살펴보자.
'전공자를 위한 생물학 > 생화학' 카테고리의 다른 글
| [생화학] 5.2 : 카이모트립신(chymotrypsin) (0) | 2024.11.07 |
|---|---|
| [생화학] 5.1 : 효소(enzyme)의 특징 - 3 (0) | 2024.11.07 |
| [생화학] 5.1 : 효소(enzyme)의 특징 - 1 (0) | 2024.11.07 |
| [생화학] 4.5 : 근육의 수축 (0) | 2024.11.07 |
| [생화학] 4.4 : 항원-항체 상호작용(antigen-antibody interaction) (0) | 2024.11.06 |