.
이번 포스트에서는 근육의 수축 메커니즘에 대해 단백질의 기능을 위주로 살펴보자.
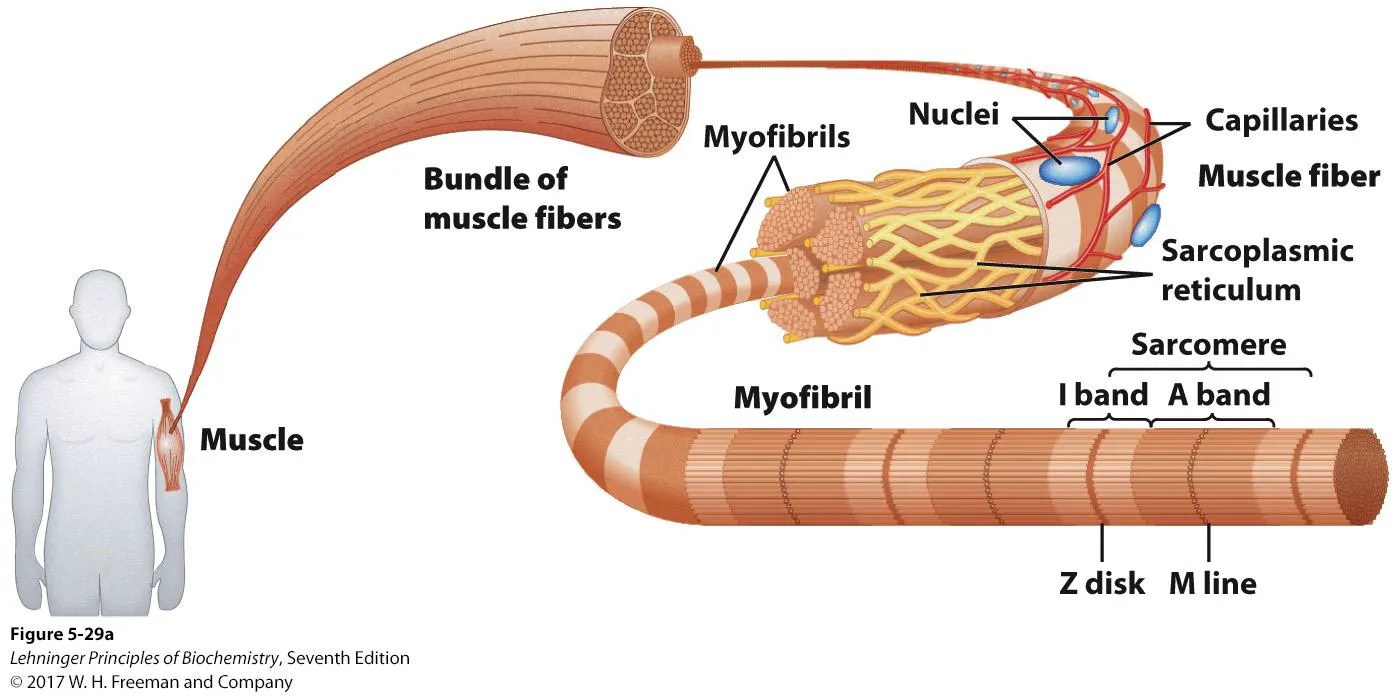
위 그림은 muscle의 구조를 보여주고 있음. 보면 myofibril이라는 가장 작은 단위들이 모여있는 구조가 관찰됨. 이 때 myofibril은 actin과 myosin을 포함하고 있음.
한편 sarcoplasmic reticulum은 endoplasmic reticulum의 일종으로, calcium을 저장하는 역할을 함.
myofibril은 thick filament와 thin filament로 구성되는데, 이 중 thick filament는 myosin으로, thin filament는 actin으로 구성되어 있음.

위 그림은 thick filament, 즉 myosin의 구조를 나타내주고 있음. 일단 이 녀석은 C terminal 근방의 경우 두 가닥의 polypeptide가 모여 형성된 coiled coil 구조를 형성하고 있음. 이 구조는 전체 구조를 유지하는데 기여함. 한편 N terminal 근방에는 또 전혀 다른 domain들이 형성되어있는데, 이 부위를 myosin head라 부름. 이 head 부분이 molecular motor로 기능하게 되며, ATP를 소모하면서 이 부분에 거대한 conformational change가 유발되게 됨. 그리고 myosin은 총 6개의 subunit으로 이루어져 있는데, 기다란 subunit 2개, 그리고 그 subunit의 head 부분에 2개씩의 light chain들이 달려있는 형태임.

위 그림은 thin filament, 즉 actin의 구조를 나타내주고 있음.
각각의 actin monomer들을 G(globular) actin이라고 하며, 이들이 모여서 filament 구조를 만들게 되면 F(filamentous)-actin이라 부름.

실제로는 위와 같이 myosin head가 actin filament 내의 actin 하나하나와 상호작용하게 됨.

실제로는 위와 같이 근수축이 이루어짐. 보면 thick filament의 양 가쪽에 thin filament가 겹쳐져 있음. 이 때 relaxed 되어있을때는 겹쳐진 부분이 많이 없고, 실제로 A band 가운데에 연한 부분도 관찰됨. 그런데 contracted되어있을 때는 겹쳐진 부분이 엄청 많고(즉, naked된 thick filament 부위가 거의 없고) I band도 짧아지게 됨.
한편 Z disk는 thin filament를 잡아주는 역할이라고 보면 됨. 이 때 Z disk와 다음 Z disk 사이, 즉 muscle contraction의 unit을 sarcomere라고 함. 이 sarcomere는 근수축시 짧아지게 됨.
그렇다면 어떻게 이러한 contraction이 일어날 수 있을까. 가장 중요한 것은 당연히 chemical energy, 즉 ATP임. 이 ATP가 가수분해될 때의 에너지에 의해서 conformational change가 유발되고, 그 결과 contraction이 일어나게 됨. 이 밖에, ATP를 사용할 시, ATP가 ADP로 가수분해되고 나면, 별도의 추가적인 process 없이는 ADP가 다시 ATP로 자연스레 바뀔 수는 없기 때문에 특정 반응을 irreversible하게 만들어주는 데도 ATP가 유용할 수 있음.
이제 본격적으로 actomyosin cycle을 알아보자.

처음에는 myosin head와 actin이 붙어있는 형태로 시작함. 그런데 ATP가 여기 들어가게 되면 이 둘이 떨어지게 됨. 이후 ATP가 ADP와 Pi로 hydrolyze되면 conformational change가 일어나 굽어있던 myosin이 약간 서게 됨. 이후 pi가 떨어져나가면서 conformational change가 유발되어서 앞서 interaction하고있던 actin보다 한칸 앞에있는 actin과 myosin head가 다시 interactoin을 하게 됨(cross-bridge). 그런데 이 상태는 매우 unstable해서 myosin head는 다시 구부러진 form으로 돌아가는데 그 결과 power stroke가 일어나서 actin filament가 한칸 앞으로 당겨지게 됨. 이때 ADP도 떨어져나가면서 다시 처음 상태와 동일해짐.
결과적으로 1개의 ATP 소모에 의해서 3-4pN 정도의 힘이 발휘될 수 있고 그 결과 thick filament를 대략 5-10nm정도 이동시킬 수 있게 됨.
그런데 위와 같은 muscle contraction은 필요할 때만 일어나야 함. 따라서 아래와 같은 regulation mechanism이 있음.

위 그림을 보면 실제로 tropomyosin이 actin과 myosin간의 interaction을 막아주는 역할을 하고 있으며 troponin이라는 애는 원래 tropomyosin과 붙어있음. 그런데 calcium ion이 있을 시 calcium ion이 Troponin C에 binding하게 되고 그 결과 tropomyosin과 troposin complex 전체의 conformation change가 일어나게 되어서 tropomyosin이 옆으로 비껴가게 되고 결과적으로 myosin과 actin이 상호작용을 할 수 있게 됨. 즉, 다시말해 calcium ion이 분비되어야 myosin과 actin이 상호작용하고, 그 결과 muscle contraction이 일어날 수 있음.
이 때 calcium ion은 sarcoplasmic reticulum에 저장되어 있으므로 실제로 NMJ를 통해 신호가 왔을 때만 이곳에서부터 calcium ion이 방출될 수 있고, 이후 신호가 끊기게 되면 다시 active하게 sarcomere 내부로 calcium ion이 pumping되면서 muscle relaxation이 일어나게 됨.
다음 포스트부터는 효소에 대해 알아보자.
'전공자를 위한 생물학 > 생화학' 카테고리의 다른 글
| [생화학] 5.1 : 효소(enzyme)의 특징 - 2 (0) | 2024.11.07 |
|---|---|
| [생화학] 5.1 : 효소(enzyme)의 특징 - 1 (0) | 2024.11.07 |
| [생화학] 4.4 : 항원-항체 상호작용(antigen-antibody interaction) (0) | 2024.11.06 |
| [생화학] 4.3 : 헤모글로빈(hemoglobin) - 2 (0) | 2024.11.06 |
| [생화학] 4.3 : 헤모글로빈(hemoglobin) - 1 (0) | 2024.11.06 |