이번 포스트부터는 헤모글로빈에 대해 알아보자.
hemoglobin은 4개의 subunit들로 이루어져 있고, 각각이 하나씩의 산소와 binding 가능해 최대 4개의 산소가 binding될 수 있음.
이 때 각 subunit의 binding site들은 서로서로 interaction을 할 수 있고, 그 결과 cooperativity에 의해서 앞서 보았던 sigmoidal한 특징을 가지게 됨.
본격적으로 hemoglobin에 대해 알아보기 전에, cooperativity라는 개념 자체에 대해 조금 더 알아보자. cooperativity는 크게 두 가지 종류로 나눌 수 있음. 우선 positive cooperativity는 첫 번째 binding event에 의해서 다른 remaining site의 binding affinity가 증가하는 것이며, 이에 대한 결과 앞서와 같은 sigmoidal curve가 얻어짐. 다음으로 negative cooperativity는 첫 번째 binding event에 의해 다른 remaining site의 affinity가 감소하는 것임.

cooperativity가 발생하는 원인은 사실 다양함. 그 중 하나가 위와 같은 상황임.
보면 위 그림에는 subunit 2개로 이루어진 단백질이 나타나 있음. 이 때 둘 다 ligand와 binding하지 않고 있을 때는 둘 사이 부위가 less stable함. 한편 둘 중 한 쪽에 ligand가 binding하고 있을 경우 둘 사이 부위가 stable해지고, 결과적으로 rigid해지게 됨. 그 결과 나머지 한 쪽의 binding site에 대한 ligand affinity가 증가하게 됨.
이제 본격적으로 cooperativity에 대해 정량적으로 생각해보자.

일단 cooperativity가 나타나려면 subunit이 여럿 있어야 함. 이 때 n개의 ligand가 protein에 붙는 과정을 위와 같이 나타낼 수 있음.

따라서 앞서와 같은 과정에 의해 Ka, Y를 각각 위와 같이 나타낼 수 있음.

이제 이 식들을 예쁘게 정리해보면 위와 같은 Hill equation이 나옴. 이 때 x축을 logL로, y축을 log((Y)/{1-y))로 둔다면 직선 graph가 나올 것임. 그런데 이 graph의 기울기 n은 사실 더이상 ligand의 갯수를 의미하는 것은 아님. 그 대신 이는 cooperativity의 정도, 종류를 이야기해주는 factor임. 따라서 이를 nH, 또는 Hill coefficient라 부름.
nH가 딱 1일 경우 cooperativity가 없음. 한편 이 값이 1보다 크면 positive cooperativity, 1보다 작으면 negative cooperativity가 있다 할 수 있음.

위 그림에는 myoglobin과 hemoglobin의 Hill equation을 plot한 graph가 나타나 있음. 우선 myoglobin의 경우 예상대로 모든 logL에 대해서 기울기가 변함없이 1임. 즉, cooperativity가 없음.
한편 hemoglobin의 경우 hemoglobin low-affinity state와 hemoglobin high-affinity state에서는 기울기가 1이지만(cooperativity가 없지만) 이들 중간 상황에서는 기울기가 3으로 positive cooperativity가 있음을 알 수 있음.
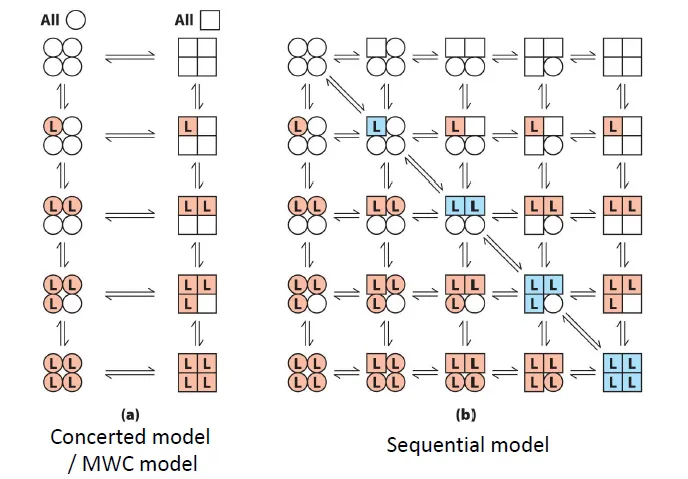
hemoglobin의 cooperativity를 설명하고자 하는 model이 위와 같이 2가지 제안됨. 이 중 concerted model(MWC model)은 4개의 subunit이 모두 동일하게 T form을 가지거나, 혹은 동일하게 R form을 가지는 상태만 가능하다는 model임. 한편 sequential model은 subunit 각각에 따라서 form이 따로따로 변화한하는 model임. 현재는 이 둘이 섞인 방식이 hemoglobin의 실제 작동 방식일 것으로 생각되고 있음.
사실 cooperativity는 allosteric regulation의 special case임. 즉, allosteric regulation이 더 넓은 개념임.
allosteric protein이란 특정 단백질의 어떤 부위에서 특정 분자와 binding하는 affinity가 동일 단백질의 전혀 다른 부분에 붙는 ligand에 의해 조절되는 것을 의미함. 이 때 allosteric regulation은 당연히 positive할수도, negative할수도 있음.
한편 allosteric regulation을 크게 두 가지로 나눌 수 있는데, homotropic과 heterotropic이 바로 그것임. (일종의 regulation 종류) homotropic은 실제로 원래 단백질의 어떤 부위에 붙는 ligand 그 자체가 allosteric site에도 붙게 되어서 allosteric regulation을 하게 되는 경우를 말함. (대표적인 예가 바로 hemoglobin인데, O2가 다른 binding site의 O2 affinity에 영향을 줌) 한편 heterotropic은 원래 단백질의 어떤 부위에 붙는 ligand와는 별개의 다른 ligand가 allosteric site에 붙게 되어서 allosteric regulation이 일어나는 경우를 말함.
이 중 cooperativity는 positive homotropic regulation에 해당함.
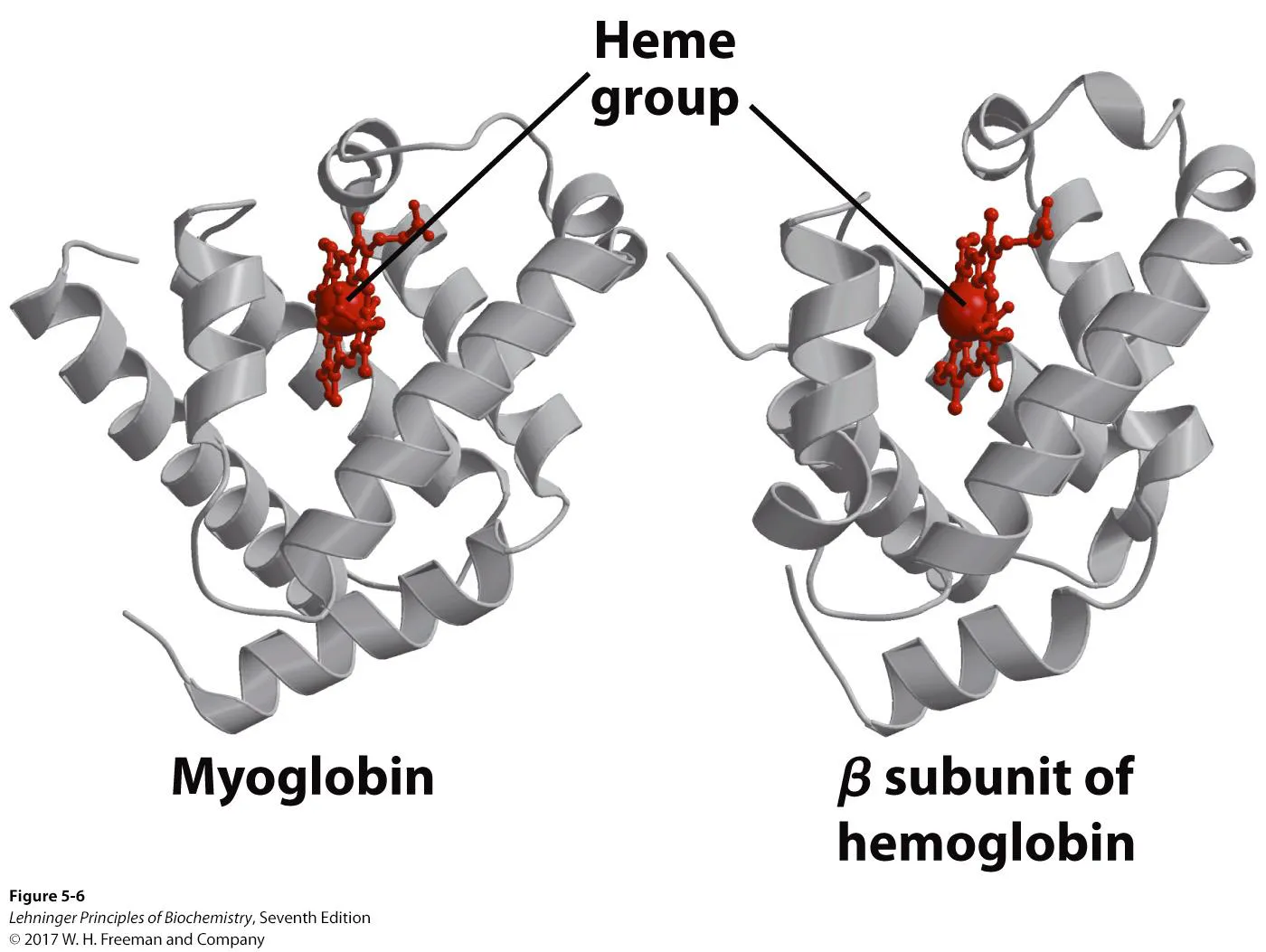
위 그림의 왼쪽은 myoglobin을, 오른쪽은 hemoglobin의 β subunit을 의미함. 이들 둘을 보면 구조가 상당히 similar하다는 것을 알 수 있음.
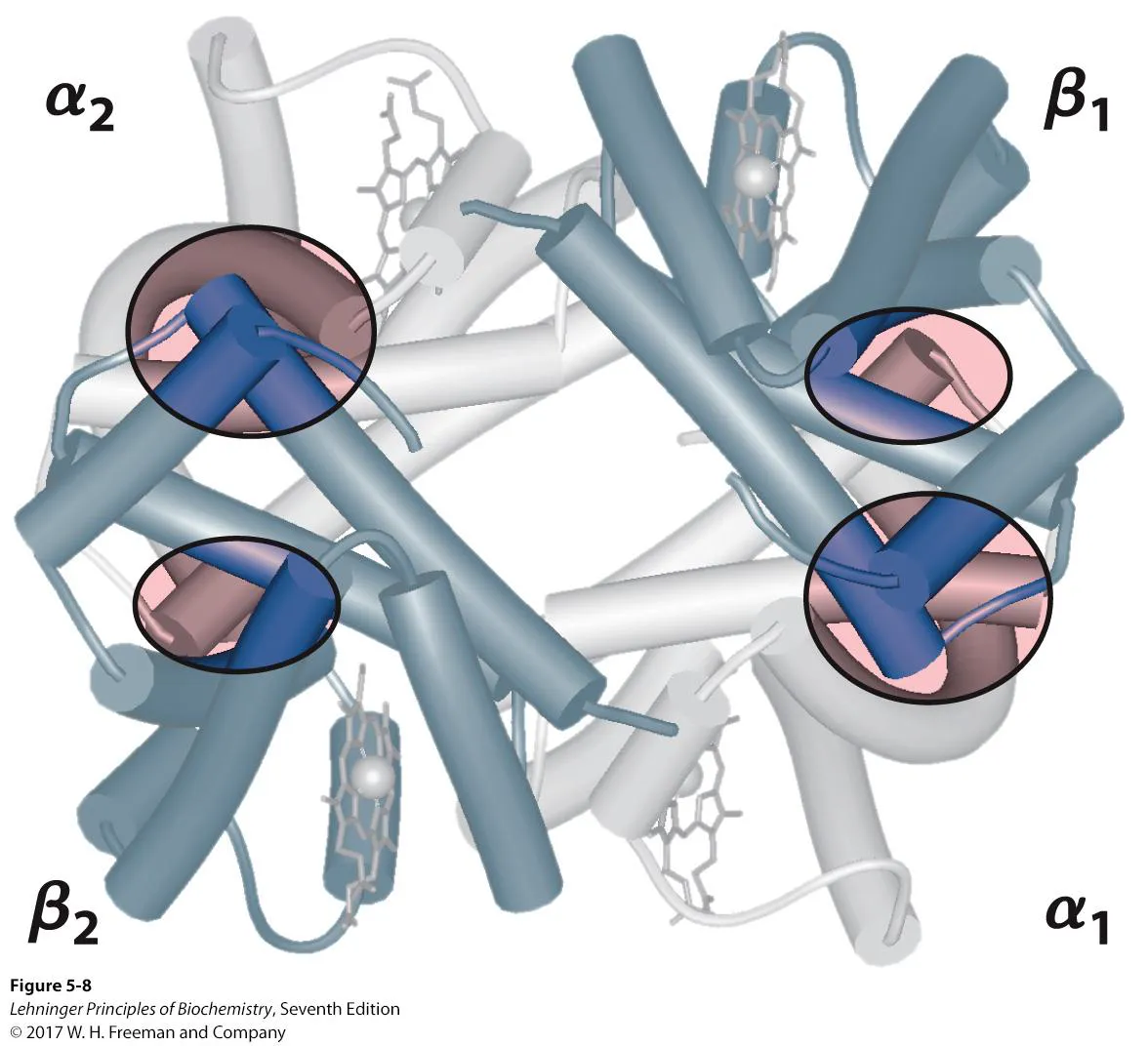
다만 hemoglobin은 위와 같이 2개의 α subunit, 2개의 β subunit이 모여 만들어진 tetramer임.
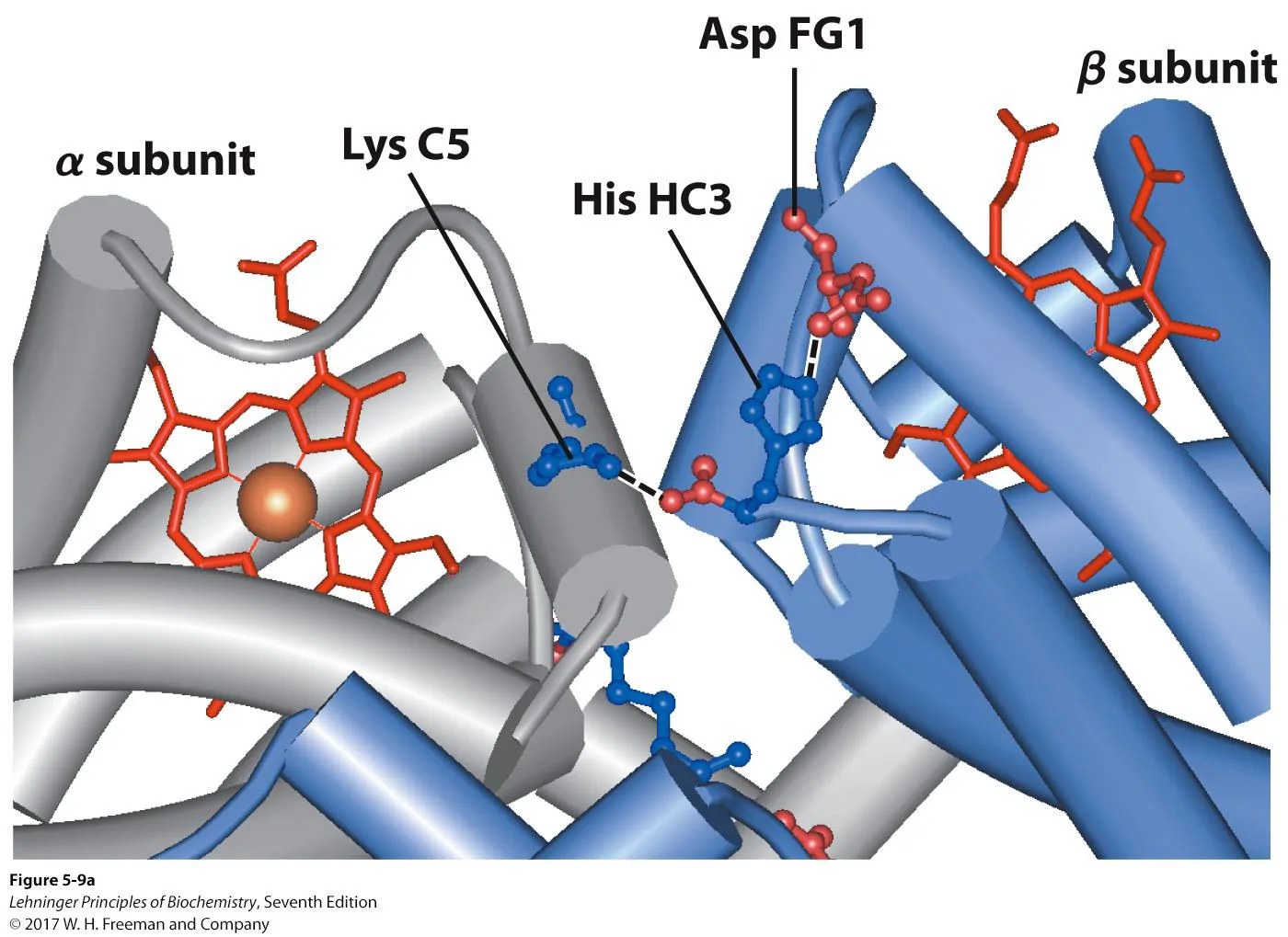
위 그림은 hemoglobin에서 subunit간의 interaction 중 일부를 보여주고 있음. 보면 α subunit의 Lys과 β subunit의 Asp, His가 모두 salt bridge에 의해 interaction하고 있는 것을 알 수 있음. 이 때 이 interaction의 center 역할을 하는게 바로 β subunit C terminal에 있는 His HC3임. 일단 His는 + charge를 띄기 때문에 - charge를 띄는 Asp FG1과 salt-bridge를 형성할 수 있음. 한편 His가 C terminal에 위치해 있기 때문에 이 경우 C terminal에 노출된 COO-가 negative charge임. 이 - charge와 Lys(+ charge)이 또 하나의 salt-bridge를 형성할 수 있음. 이러한 subunit interaction은 O2가 붙지 않은 상태에서 잘 유지되고 있음. 이렇듯 O2가 붙지 않은 상태에서의 rigid한 structure를 T state라 부름.
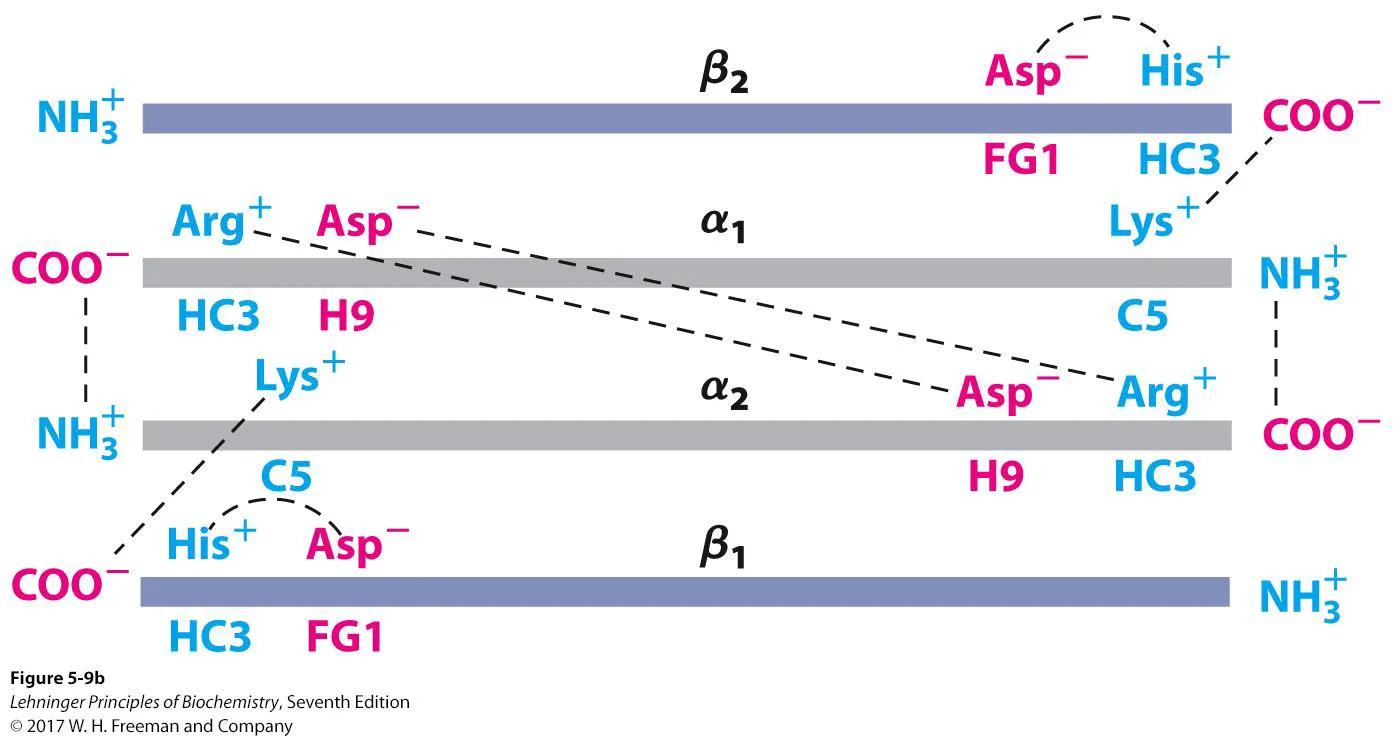
위 그림은 T state에서의 각종 interaction들을 더욱 상세하게 보여주고 있으므로 참고할 것.
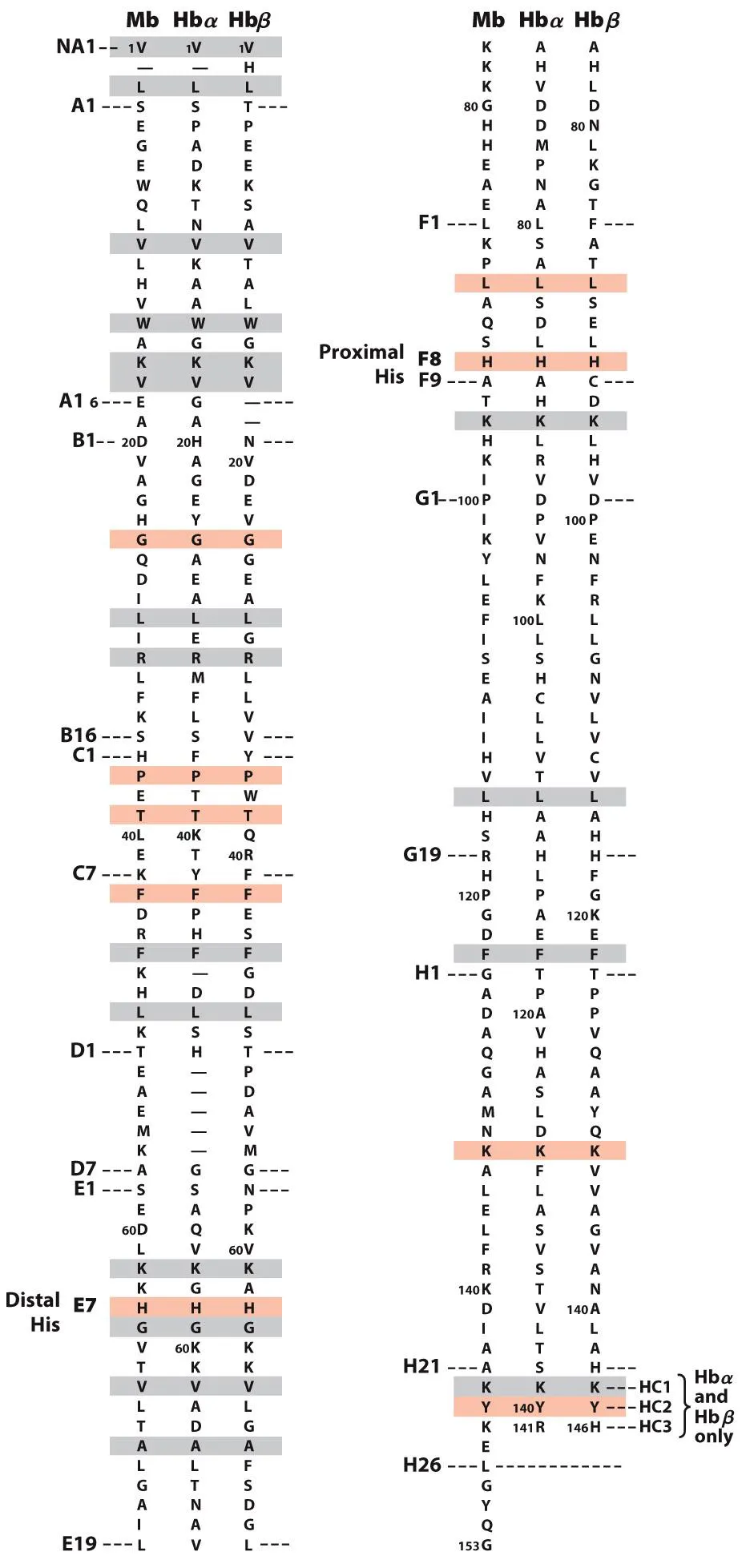
한편 위와 같이 myoglobin, hemoglobin subunit들의 sequence alignment를 해본 결과 실제로 색깔로 표시된 부분의 sequence가 similar하다는 것을 알 수 있음. 따라서 뭔가 이들은 구조, 기능적으로 비슷할 수 있음을 알 수 있음.
앞서 말했듯 산소가 붙지 않은 상태에서 subunit끼리 interaction을 더 많이하고 더 stable한 상태를 T state(tense state)라 함. 한편 산소가 붙게 되면 interaction 수가 적어지고 더 flexible해지면서 R state(relaxed state)로 변하게 됨. 즉, 산소의 binding이 T→R로의 conformational change를 유발하게 됨.
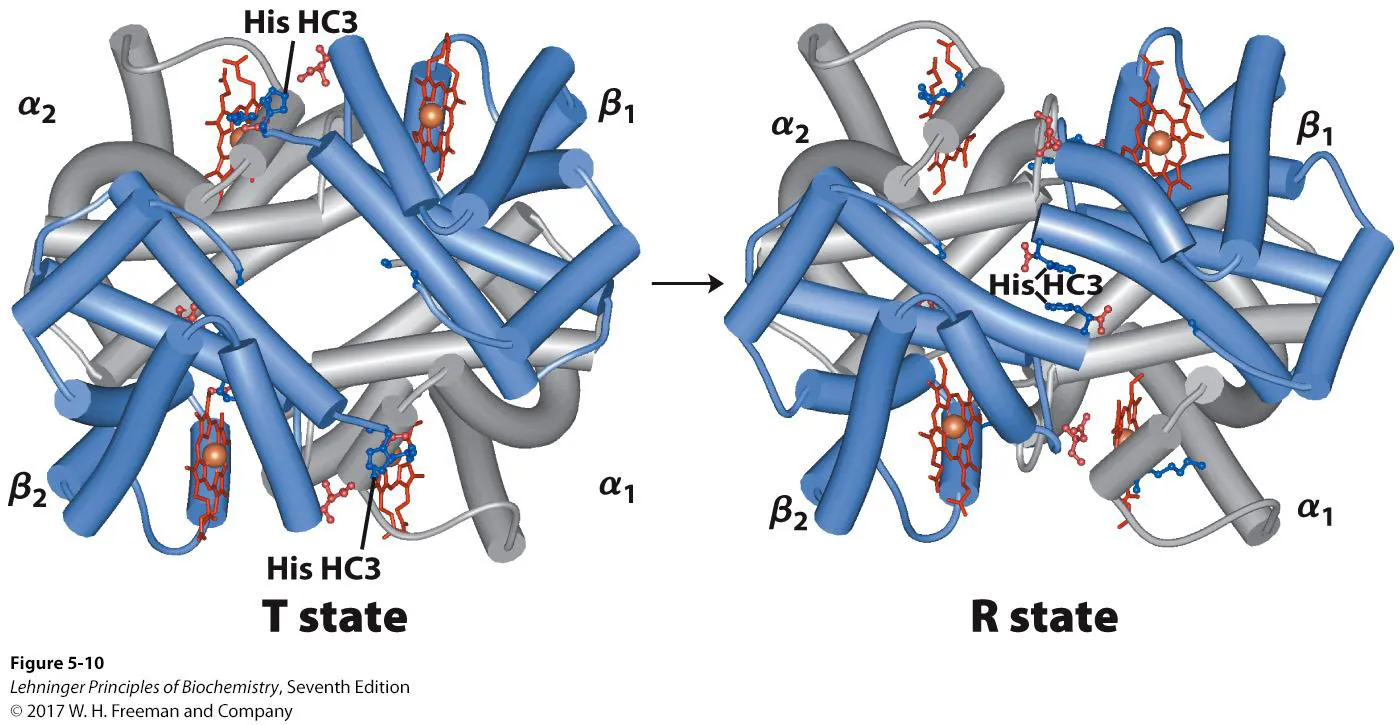
위 그림에는 실제로 T, R state가 나타나 있음. 보면 T state와는 달리 R state의 경우 가운데에 구멍이 막혀 있으며, 앞서 살펴봤던 α-β간의 interaction도 사라졌다는 것을 알 수 있음.
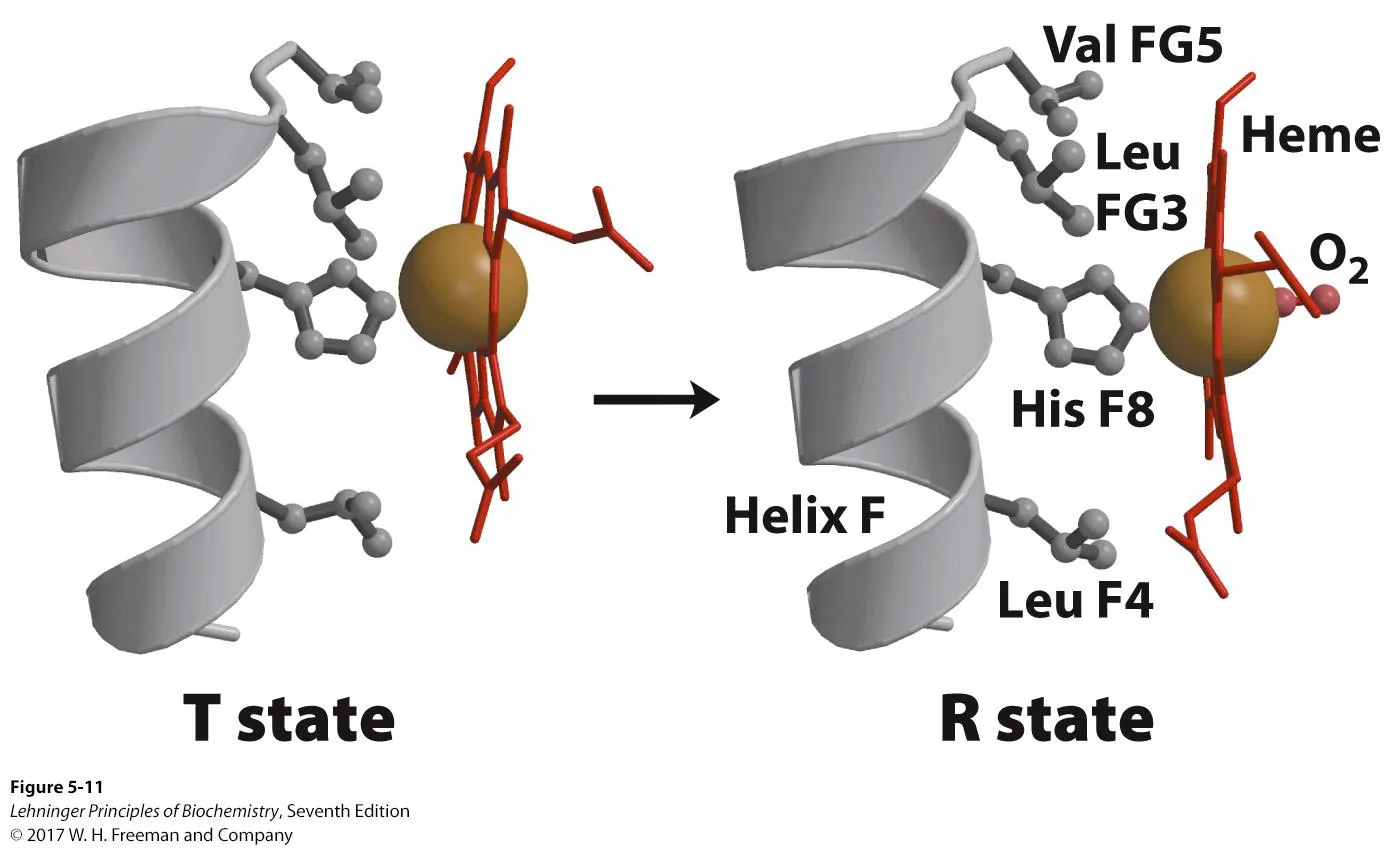
위 그림은 조금 더 heme group에 집중해서 T, R state를 비교한 것임. 보면 T state의 경우 사실 Fe가 5개와만 coordination되어 있으므로 interaction balance가 맞지 않음. 그 결과 heme group이 살짝 휘어있고, helix의 His또한 왼쪽으로 조금 밀려나 있는 것을 알 수 있음. 한편 R state에서는 Fe에 산소가 추가적으로 coordination되어 interaction balance가 맞게 되므로 heme이 보다 더 planar해지고 helix의 His도 오른쪽으로 더 끌려오게 됨. 그 결과 helix 전체가 오른쪽으로 더 끌려오게 되고 전반적인 구조변화가 초래되게 됨.
다음 포스트에서는 헤모글로빈이 산소와 결합하는 세기가 pH에 따라 어떻게 달라지는지에 대해 알아보자.
'전공자를 위한 생물학 > 생화학' 카테고리의 다른 글
| [생화학] 4.4 : 항원-항체 상호작용(antigen-antibody interaction) (0) | 2024.11.06 |
|---|---|
| [생화학] 4.3 : 헤모글로빈(hemoglobin) - 2 (0) | 2024.11.06 |
| [생화학] 4.2 : 미오글로빈(myoglobin) (0) | 2024.11.06 |
| [생화학] 4.1 : protein과 ligand (0) | 2024.11.06 |
| [생화학] 3.6 : 단백질 항상성(proteostasis) - 2 (0) | 2024.11.05 |