이번 포스트부터는 globin 단백질을 통해 산소가 수송되는 과정에 대해 생화학적 관점에서 살펴보자.
globin의 일종인 myoglobin은 subunit이 1개인 반면 hemoglobin은 subunit이 4개임. 이들 둘 다 cofactor도 비슷하고, O2와 binding한다는 사실 자체도 비슷함. 다만 차이도 있음. (흔히 myoglobin은 산소를 storage하고, hemoglobin은 산소를 transport함)
protein의 side chain들은 어떤 종류가 오더라도 O2와 강한 affinity를 보일 수 있는 녀석들이 없음. 물론 몇몇 transition metal들은 O2와 아주 잘 붙음. 그러나 transition metal이 solution에 free한 상태로 있을 경우 이 녀석이 너무나 reactive한 나머지 free radical을 형성하는 결과를 낳을 수도 있음.
이 단점을 어느정도 해결해주는 것이 바로 heme과 같은 organometallic compound임. 이 경우 free heme 내부에 있는 Fe2+가 산소와 결합 가능함. 그러나 이 녀석 또한 전자 하나를 잃으면서 Fe3+로 산화되면서 매우 reactive해질 수 있음.
따라서 이런 문제를 종합적으로 해결하는 방안이 바로 protein에 cofactor의 형태로 heme이 존재하는 globin임.

위 그림 a에 나온 것은 porphyrin ring의 구조이며, 이들의 중간에 metal, 그 중에서도 Fe가 자리하고 있는 b의 구조를 heme이라 부름. 특히 b에서 볼 수 있는 것과 같이 Fe는 porphyrine ring의 N과 총 4개의 coordination을 형성하고 있음.

한편 이 ring에 더해서, 위와 같이 globin 내부의 histidine residue N과 추가적인 coordination을, 그리고 O2가 있을 때는 O2와도 coordination해서 결과적으로 최대 6개까지 coordination하는 것이 가능함. (일반적으로 metal coordination에 가장 적합한 원소가 바로 N, O와 같은 것들임)

위 그림은 실제 myoglobin의 구조를 보여주고 있음. 보면 ring 주변에 일단 매우 인접해있는 His 93이 있음. 이 녀석은 proximal His residue라 부름. 한편 His 64처럼 조금은 ring에서 떨어진 His가 있는데 이 녀석을 distal His residue라 부름.
한편 CO, 즉 carbon monoxide(일반적으로 연탄의 불완전연소 산물로 많이 알려져 있음) 또한 size와 shape 측면에서 O2와 비슷하기에 산소와 동일한 binding site에 결합할 수 있음. 심지어 free heme만 놓고본다면 산소에 비해 CO가 20,000배정도 더 잘 heme과 결합함. 물론 heme이 protein에 포함되어서 protein pocket이 형성되어 있을 경우 이 정도는 감소하기는 하나 그래도 산소에 비해 250배정도 더 잘 결합함.
CO는 상당히 toxic하고 게다가 한 번 붙으면 잘 떨어지지도 않음. 따라서 CO는 heme을 가지는 myoglobin, hemoglobin, mitochondrial cytochrome 등의 function을 block할 수 있음.

실제로 위 그림 a, b에 free heme과 결합하는 산소, CO에 대한 모식도가 나타나 있음. 보면 산소는 약간 tilt된 채로 coordination되지만 CO는 보다 더 linear하게 coordination됨. 이를 봐도 b가 energy적으로 더 안정하다는 것을 알 수 있을 것임.

그런데 위와 같이 실제로 heme이 protein에 달라붙어서 protein pocket이 형성되어 있는 상황이라면 이야기는 달라짐. 보면 실제로 tilt되어있는 산소 분자 중 나머지 한쪽이 distal His residue와 수소결합을 통해 결합하면서 안정화됨. 한편 CO의 경우에도, 어쩔 수 없이 protein pocket의 모양이 저렇기 때문에 tilt되어야 하는데, 그러면서 에너지가 상대적으로 불안정해짐. 게다가 CO는 산소에 비해 수소결합도 잘 못함. 그 결과 affinity가 free heme에서보다는 떨어지게 되는 것임.
heme group은 spectroscopic detection을 통해 signal을 관찰할 수 있는 대표적인 chromophore임. 특히나 oxygen의 binding 여부는 UV-Vis spectrophotometry로 측정 가능한데, deoxyhemoglobin이 많을수록 purplish하게 보이고(429nm), oxyhemoglobin이 많을수록 red로 보임(414nm). 따라서 나타나는 색의 파장대를 통해서 oxygen의 binding 여부, 정도를 측정할 수 있음.
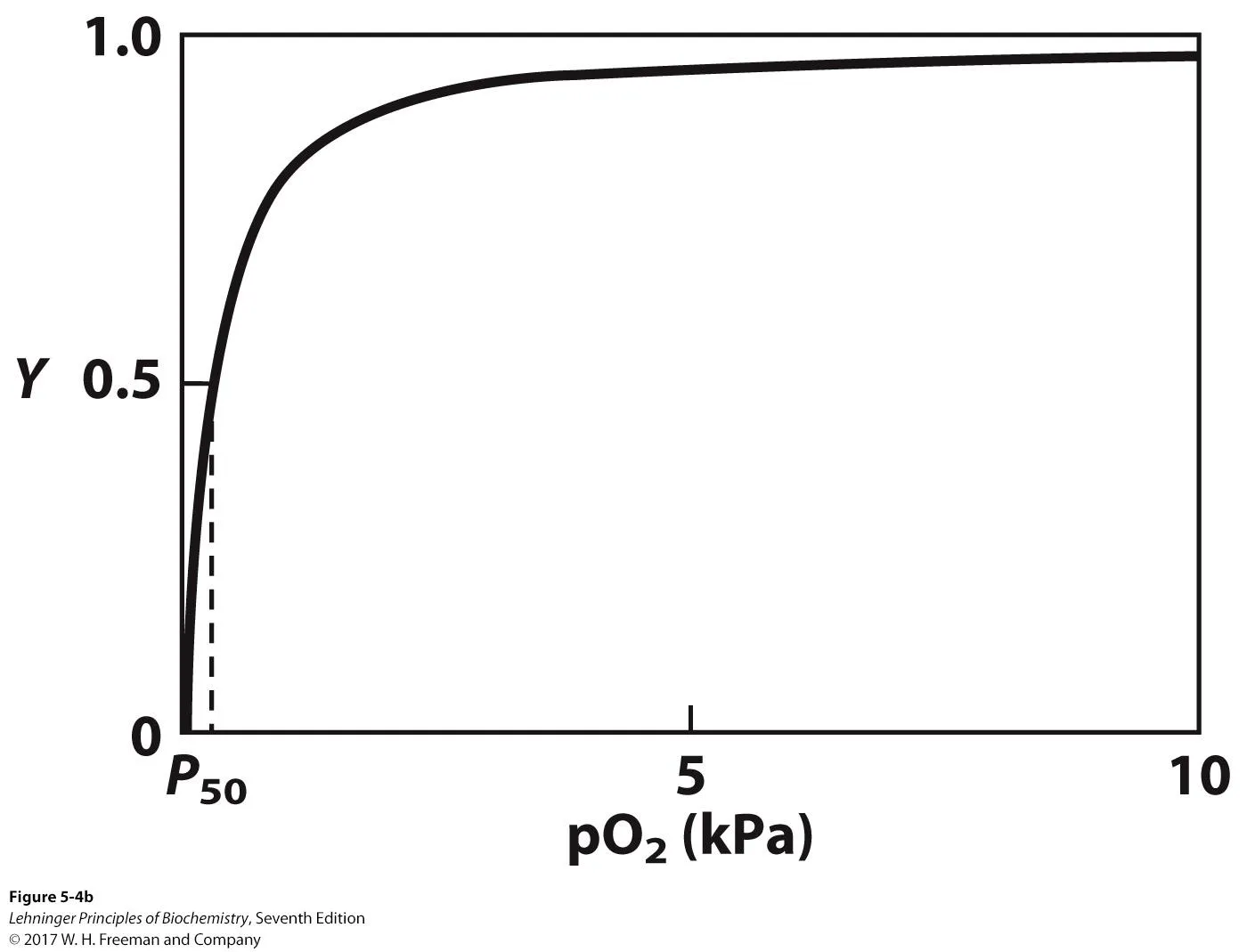
그 결과 위와 같은 occupancy graph를 쉽게 그릴 수 있음. 특히나 위 graph는 myoglobin의 graph임.
일반적으로 lung의 pO2를 13kPa로, tissue의 pO2를 4kPa로 생각하는데, 위 graph상에서 이들에서의 Y를 비교해보면 lung에서나 tissue에서나 거의 Y가 1에 가까움. 이 말인즉슨 myoglobin은 lung 뿐만 아니라 tissue 환경에서도 산소를 store하고 있음.
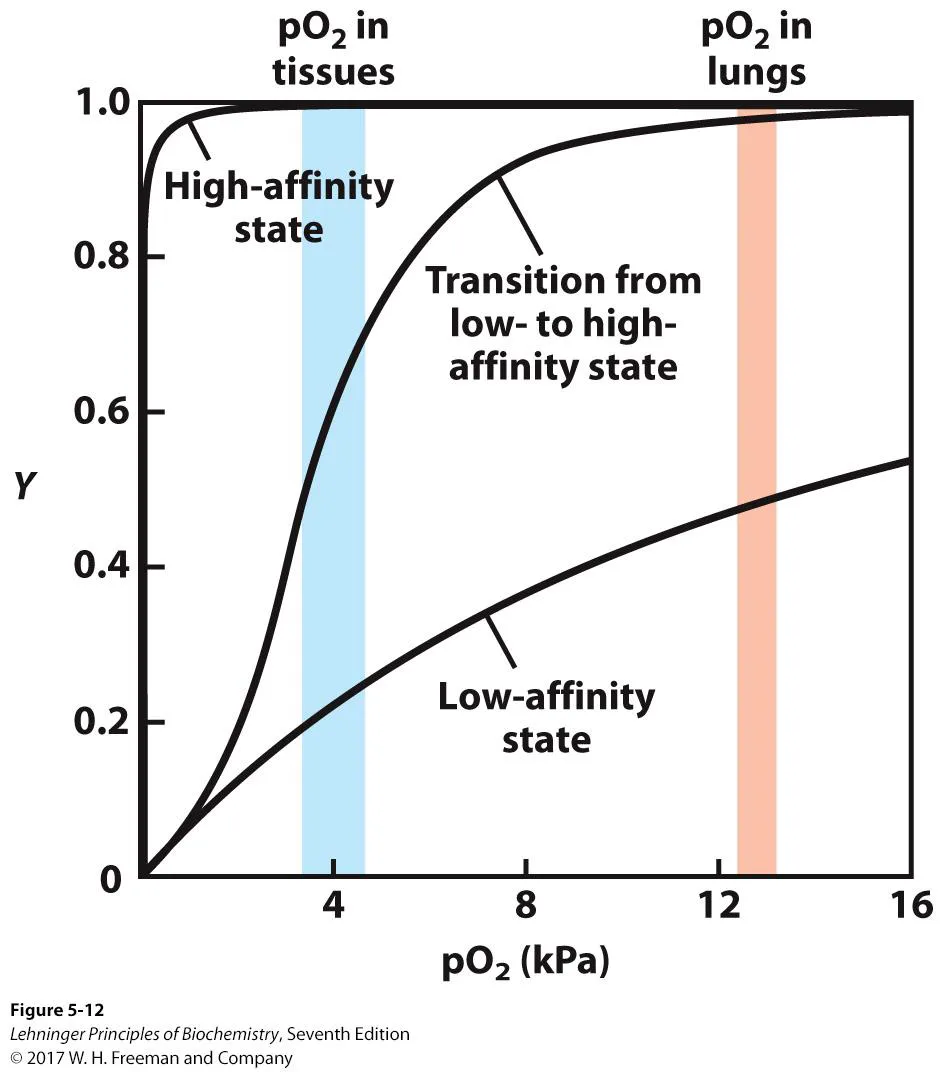
위 graph에서 high-affinity state가 바로 myoglobin의 경우임. 이 때 myoglobin에 비해 산소에 대한 affinity가 낮아진 low-affinity state가 되면 산소를 잘 운반할 수 있을까? 위 graph를 보면 그렇지만은 않다는 것을 알 수 있음. (lung에서의 affinity도 덩달아 낮아져 less effective함) 한편 high-affinity state와 low-affinity state의 graph 평균을 낸, sigmoidal curve가 hemoglobin의 curve임. 이 경우 lung에서는 산소를 잘 받고 tissue에서는 산소를 잘 release할 수 있게 됨. hemoglobin은 이런 상태를 위해서 tertiary structure에 더해 quaternary structure를 가지고 있음.
다음 포스트에서는 hemoglobin에 대해 알아보자.
'전공자를 위한 생물학 > 생화학' 카테고리의 다른 글
| [생화학] 4.3 : 헤모글로빈(hemoglobin) - 2 (0) | 2024.11.06 |
|---|---|
| [생화학] 4.3 : 헤모글로빈(hemoglobin) - 1 (0) | 2024.11.06 |
| [생화학] 4.1 : protein과 ligand (0) | 2024.11.06 |
| [생화학] 3.6 : 단백질 항상성(proteostasis) - 2 (0) | 2024.11.05 |
| [생화학] 3.6 : 단백질 항상성(proteostasis) - 1 (0) | 2024.11.05 |