이번 포스트에서는 단백질 항상성을 위해 중요한 샤페론(Chaperone)과 샤페로닌(Chaperonin)에 대해 알아보자.
chaperone의 대표적인 예로는 Hsp(heat shock protein)가 있음. (참고로 Hsp라고 해서 무조건 heat shock이 왔을때만 induce되는 것은 아님)

위 그림에는 Hsp70(질량이 70kDa)과 Hsp40에 의해 folding intermediate가 제대로 접히게 되는 과정이 나타나 있음.
보면 energy적으로 불안정한 folding intermediate들이 Hsp70과 interaction을 하면서 energy가 변화하게 됨. 그 결과 folding intermediate들이 N으로 가는 것을 도와주게 됨. 구체적으로는, 위 그림에서와 같이 Hsp70이 ATP와 결합하고 있을 때는 folding intermediate와 interaction하며 open된 상태인데, ATP의 가수분해가 일어나게 되면 위 그림 오른쪽 아래와 같이 Hsp70이 닫히면서 folding intermediate를 꽉 잡아주게 되고 결과적으로 native protein으로 변화하기 쉽도록 만들어줌. (참고로 ADP는 NEF에 의해 떨어져나갈 수 있고, 이후 ATP가 다시 충전되면서 위 그림 왼쪽 아래와 같은 상태로 다시 돌아갈 수 있음)
이런 식으로 chaperone들은 protein이 잘 folding되게 도와줌. 이 때 직접적으로 잘못 접힌 protein 구조를 풀어준 다음에 다시 접히게 해주는 unfoldase로 기능하는 경우도 있고, 그냥 단지 방금 본 예시처럼 protein들을 잡아서 잘 접히게 해주는 holdase로 기능하는 경우도 있음.
다음으로 chaperonin에 대해 알아보자.

이 녀석은 아주 거대한 chaperone complex임. 이들을 구성하는 각각의 subunit은 Hsp60임.
보면 GroEL과 GroES가 pair를 이뤄 작동하게 됨. 일단 GroEL 가운데에 있는 hole로 folding intermediate가 들어가게 됨. 이후 GroEL에 ATP가 붙게 되면 GroES가 GroEL 위에 뚜껑처럼 덮이게 됨. 이 결과 hole 내부에 isolate된 공간이 형성되고, 이 곳에서 Hsp에 의해 protein의 proper한 folding이 이루어지게 되는 것임. 한편 이후 GroEL의 ATP가 가수분해되어 ADP로 바뀌게 되면 반대편 chamber에 또 다른 folding intermediate가 접근하게 됨. 이후 반대편 GroEL에 ATP가 와서 붙으면 앞서 붙어있었던 GroES 뚜껑이 떨어져나가며 앞서 folding되었던 protein은 release되고, 반대편에 GroES 뚜껑이 씌워지게 됨.
이 때 이 complex의 경우 흥미롭게도 위 그림에서도 알 수 있듯이 한쪽 뚜꼉이 닫히면 나머지는 open되어서 protein을 받아들이게 됨. 결국 2개의 chamber가 번갈아가면서 동작하게 되는 것.
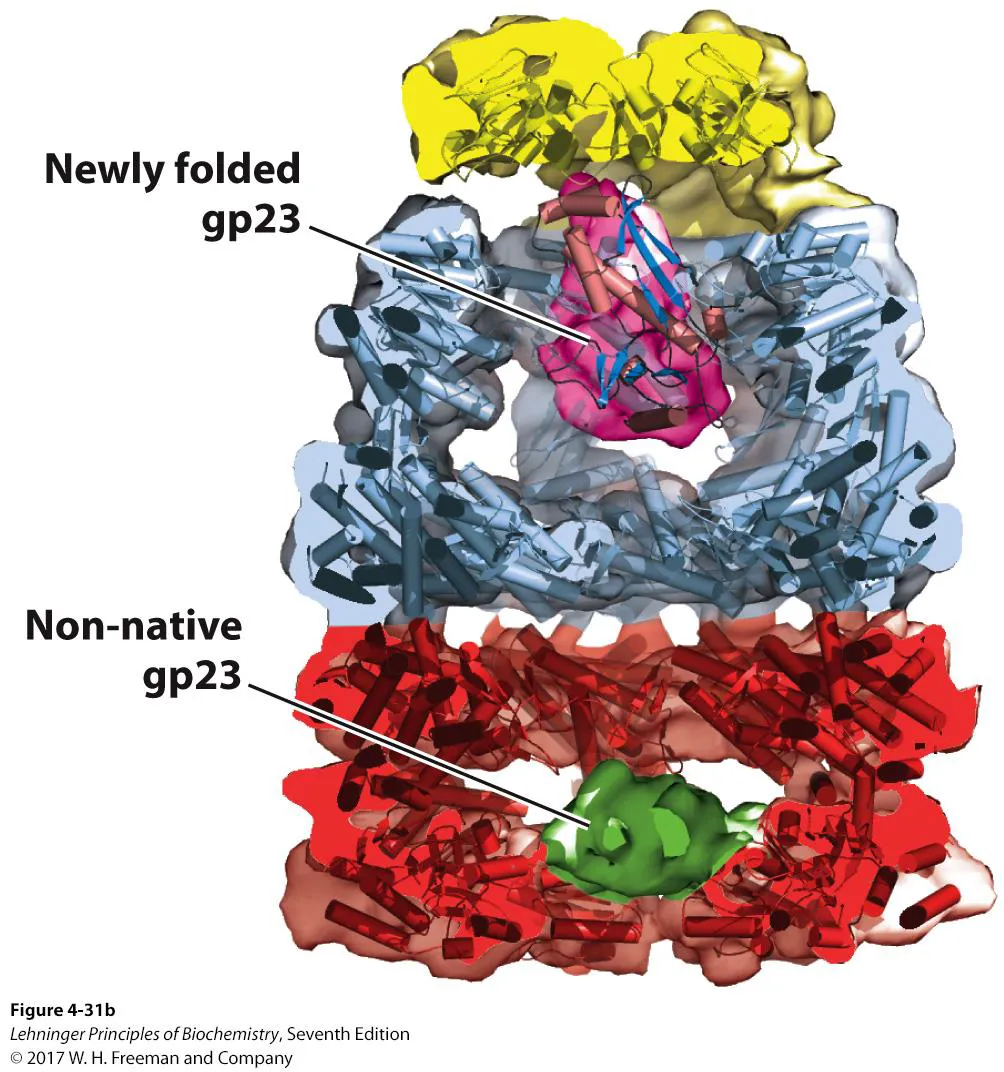
chaperonin의 구조는 위와 같으며 이는 Cryo-EM에 의해 결정됨. 보면 실제로 2개의 chamber가 존재하고 있음을 알 수 있음.
지금까지는 protein의 proper한 folding을 도와주는 녀석들에 대해 살펴봤음.
이제 native structure의 protein에 somehow 이상이 생겨 형성되는 misfolded protein에 대해 알아보자.
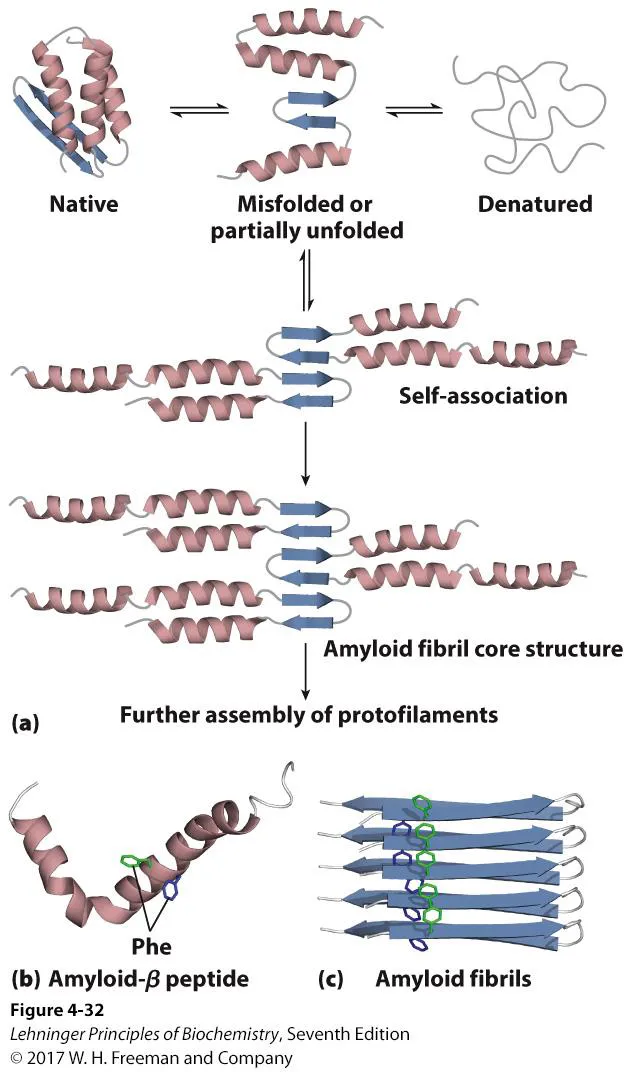
위 그림을 보면 native structure의 protein이 여러 과정을 거친 결과 아예 구조가 완전히 달라진(망가진) 형태의 misfolded protein이 된다는 것을 알 수 있음.
이런 식으로 형성되는 misfolded protein들이 모여서 만들어질 수 있는 대표적인 구조가 바로 위 그림 c에 나타나 있는 amyloid fibril임. 이 경우 β-strand끼리 잘 packing되어서 firbirl의 형태로 만들어지는 구조이며 이 fibril은 알츠파이머에서 관찰되는 대표적인 특징으로, 이 녀석에 의해 세포가 괴사하게 됨. (이 밖에 알츠하이머에서는 IDP의 일종인 tau protein들도 제대로 된 구조가 없다 보니 자기들끼리 aggregate된 결과 이상한 구조를 형성함)
참고로 이렇듯 protein misfolding의 결과 amyloid가 만들어지는 현상을 amyloidosis라 함.
다만 구체적으로 어떻게 이런 구조가 만들어지는지, 그리고 이들 구조가 어떻게 세포를 죽이는지와 관련해서는 아직도 많은 연구가 진행되고 있음.
다음 포스트부터는 단백질의 기능에 대해 자세히 알아보도록 하자.
'전공자를 위한 생물학 > 생화학' 카테고리의 다른 글
| [생화학] 4.2 : 미오글로빈(myoglobin) (0) | 2024.11.06 |
|---|---|
| [생화학] 4.1 : protein과 ligand (0) | 2024.11.06 |
| [생화학] 3.6 : 단백질 항상성(proteostasis) - 1 (0) | 2024.11.05 |
| [생화학] 3.5 : 단백질의 구조 결정 방법 (0) | 2024.11.05 |
| [생화학] 3.4 : 단백질의 3차구조(tertiary structure) - IDP (0) | 2024.11.05 |