이번 포스트에서는 2개의 substrate가 있을 때의 반응에 대해 알아보자.
이 경우 특히나 substrate의 binding, product의 release와 관련된 kinetic mechanism을 이해하는 것이 중요함.
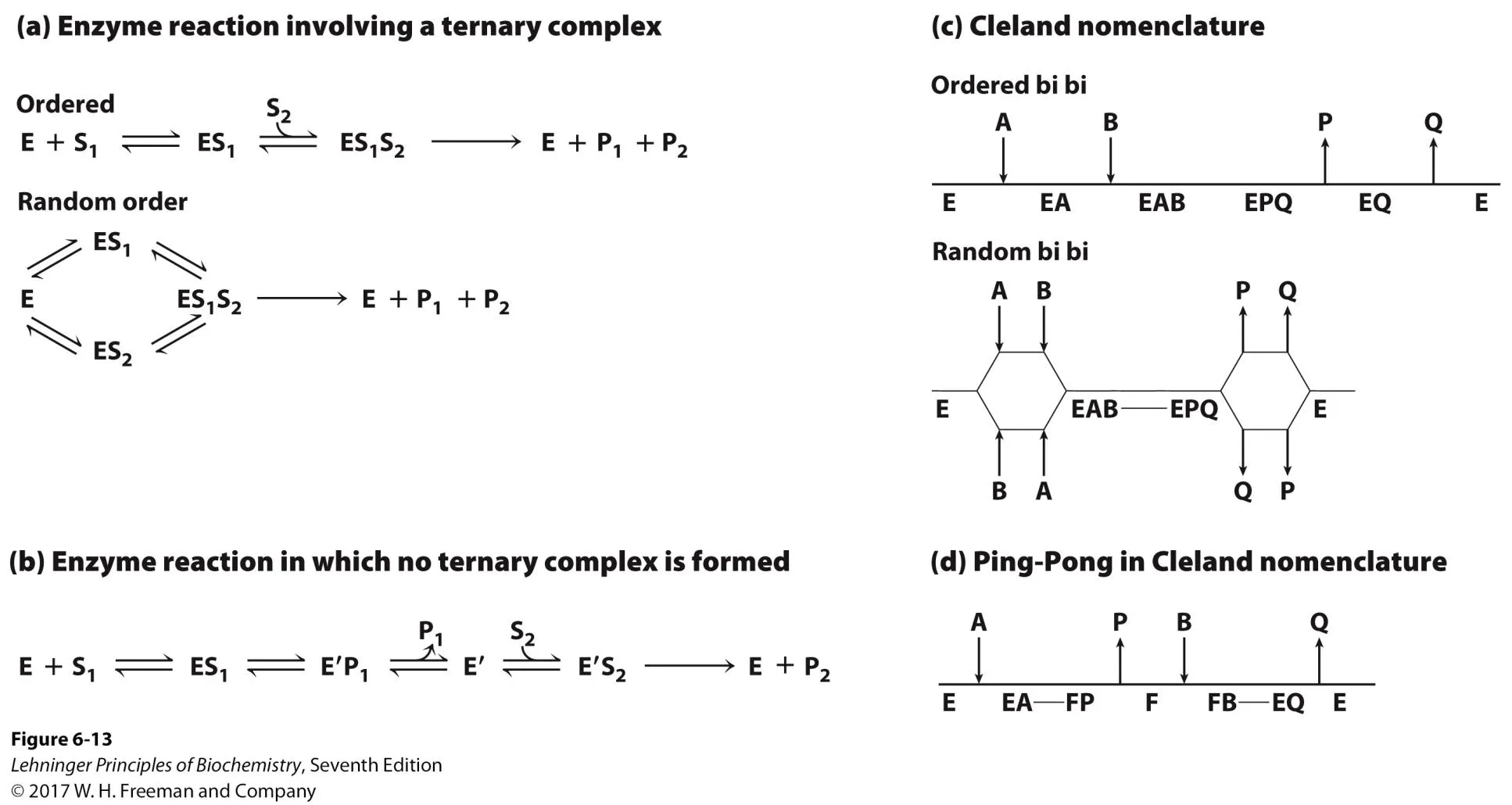
실제로 two-substrate reaction과 관련해 2가지의 kinetic mechanism이 있음. 첫 번째는 위 그림 (a)에 나타나 있는 sequential mechanism이고 두 번째는 위 그림 (b)에 나타나 있는 ping-pong mechanism임. 이 중 sequential mechanism부터 보면, 이 경우 ordered된 채로 S1과 S2가 순서대로 첨가되어서 ternary complex가 만들어진 후 생성물이 만들어지는 경우도 있고 그 밖에 S1, 혹은 S2 중 아무거나가 random하게 먼저 와서 ternary complex가 만들어지는 경우도 있음. 결과적으로 이 경우 ternary complex가 만들어진다는 것이 핵심임. 한편 ping-pong mechanism에서는 S1이 들어와 반응이 진행되어 P1이 빠져나가고, 그 이후에 다시금 S2가 들어오고 P2가 빠져나가게 됨.
참고로 위 그림 오른쪽 (c), (d)에는 Cleland nomenclature를 이용해 sequential mechanism과 ping-pong mechanism이 표현되어 있음. 이 때 Cleland nomenclature란 enzyme이 반응하는 방법을 표현하는 방식 중 하나이며, 이 때 보통 substrate는 A, B, C, D...와 같은 식으로 표기하고 product는 P, Q, S, T....와 같은 방식으로 표기하게 됨. 이외에 E는 enzyme을 의미하고, +x 방향으로 갈수록 반응이 진행됨을 의미함.
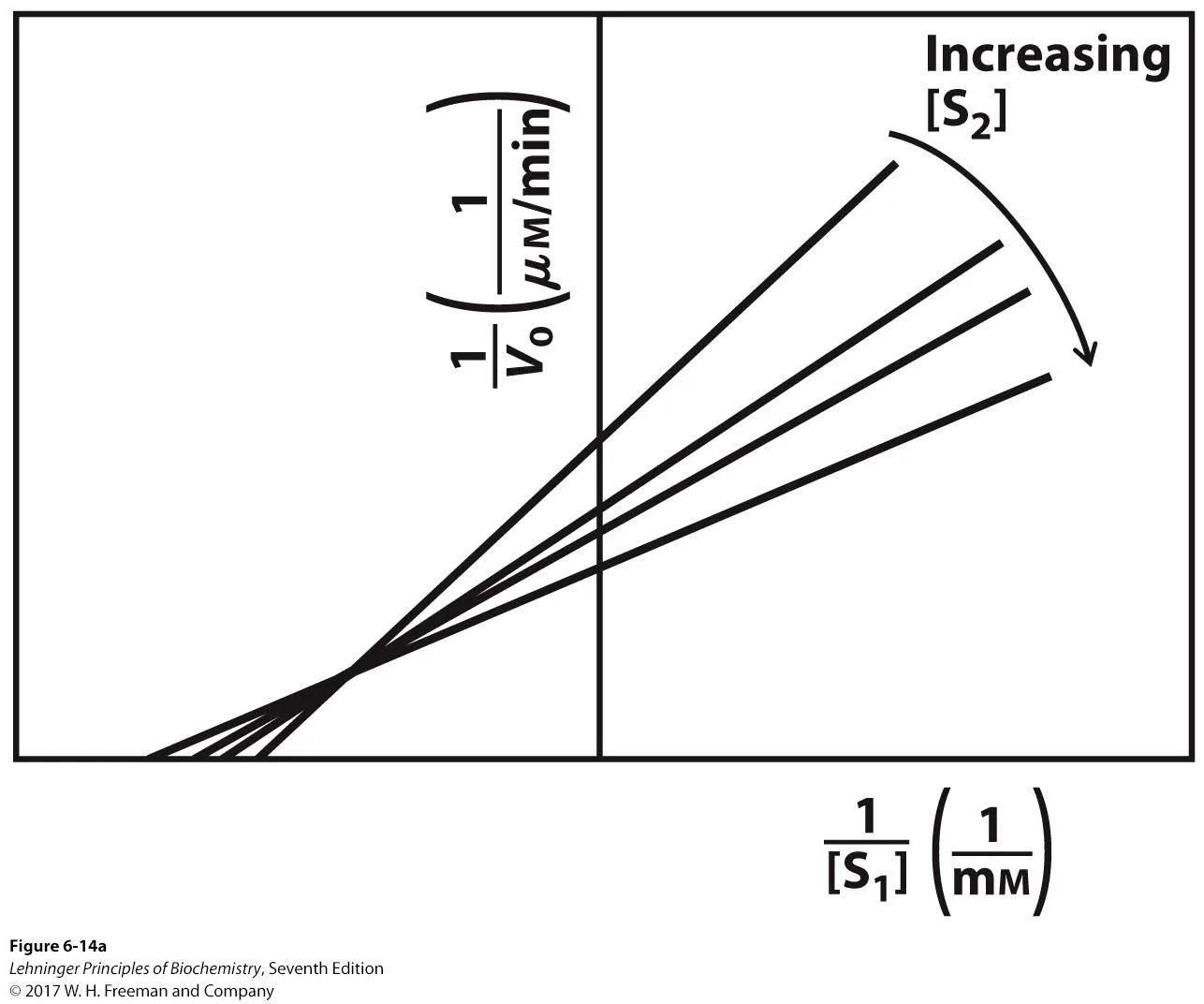
이 때 실제로 sequential mechanism을 따르는 경우 x축을 1/[S1], y축을 1/V0로 할 시 위와 같이 line이 그려짐. 이 때 S2의 농도를 증가시켜줄수록 line이 달라지는데, 이 line들을 다 한데 모아놓을 시 intersect가 생긴다는 것을 알 수 있음.

한편 ping-pong kinetic mechanism을 따르는 경우에는 위와 같이 S2 변화에 따라서 line이 평행하게 변화하는 양상을 lineweaver-burk plot 상에서 확인할 수 있음.
다음으로 inhibitor가 있을 때의 enzyme에 대해 알아보자. inhibitor란 enzyme의 activity를 줄여주는 역할을 하는 compound를 통칭하는 말임. 대부분의 경우에는 reversible inhibitor가 많지만 가끔 irreversible inhibitor도 있음. (참고로 irreversible inhibitor 중 자기를 바쳐서 irreversible한 intermediate를 형성해서 효소 작용을 block하는 녀석을 suicide inactivator라고 하기도 함) powerful한 toxin이 주로 irreversible inhibitor에 해당하게 됨.
한편 reversible inhibitor들의 경우 붙었다 떨어졌다 할 수 있는 녀석들이므로 이 경우 kinetics를 살펴보는 것이 중요함.
reversible inhibitor 중 첫 번째 종류가 바로 competitive inhibitor(경쟁적 저해제)임.
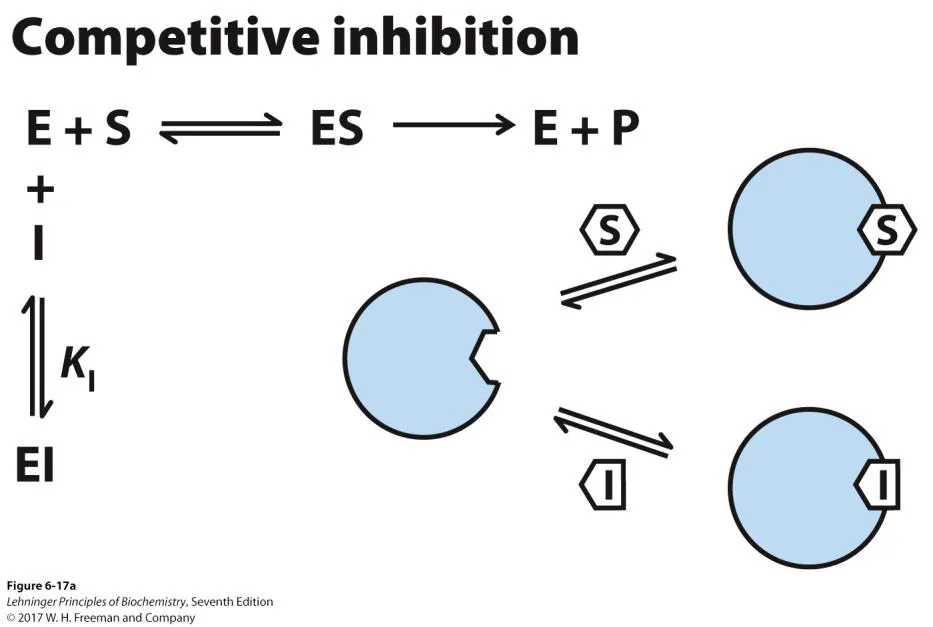
이 경우 위와 같이 inhibitor가 enzyme 상에서 substrate가 붙는 부위와 동일한 곳에 붙어 substrate와 경쟁적으로 작용하게 됨. 이 때는 enzyme의 kinetics 자체가 달라지는 건 아님. 따라서 substrate가 충분히 많을 경우 원래 enzyme의 Vmax와 동일한 initial reaction rate까지 도달할 수 있음. 그리고 substrate 자체에 대한 Km도 그대로일 것임. 그러나 competitive inhibitor가 들어갈 시 apparent하게 보이는 KM 값은 증가하게 됨. (상대적으로 substrate와 enzyme간의 affinity가 감소한 '듯한' 효과)

이 경우의 수식은 위 그림 왼쪽과 같이 유도될 수 있음.
그 결과 얻어진 V0 식을 이용해 위 그림 오른쪽과 같이 plotting을 해보게 되면 결과적으로 y절편은 동일하고 I의 양에 따라서 기울기만 달라지는 형상이 관찰되게 됨. (즉 y axis 상에서 intersect함)
다음으로 살펴볼 inhibitor는 uncompetitive inhibitor(불경쟁적 저해제)임.
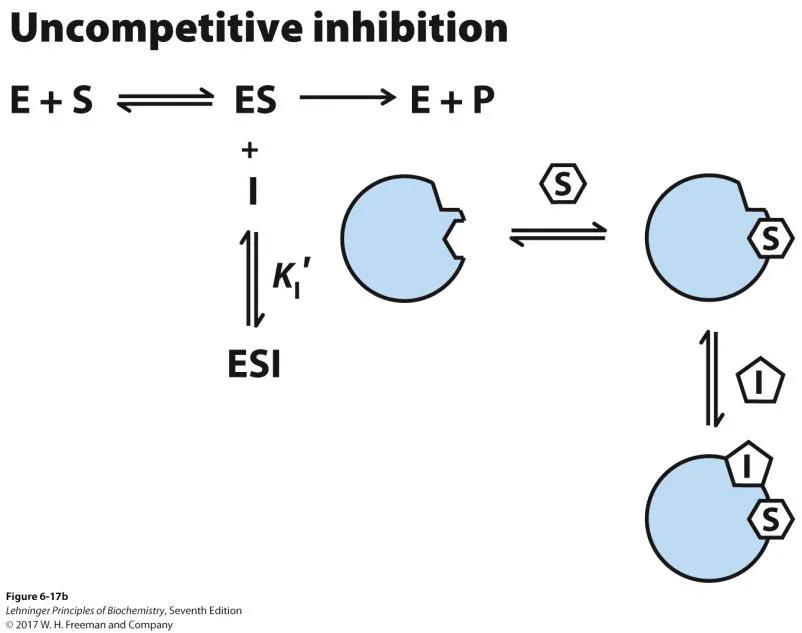
이 경우 substrate와 inhibitor가 competition하는 것은 아님. 다만 substrate가 붙고 나서 이후 inhibitor가 붙게 되면서 이에 의해 enzyme의 catalytic activity가 감소하게 됨.
이 경우 Vmax값이 감소하며 apparent KM 값 또한 감소하게 됨. 대신 KM/Vmax의 비율은 변하지 않게 됨.
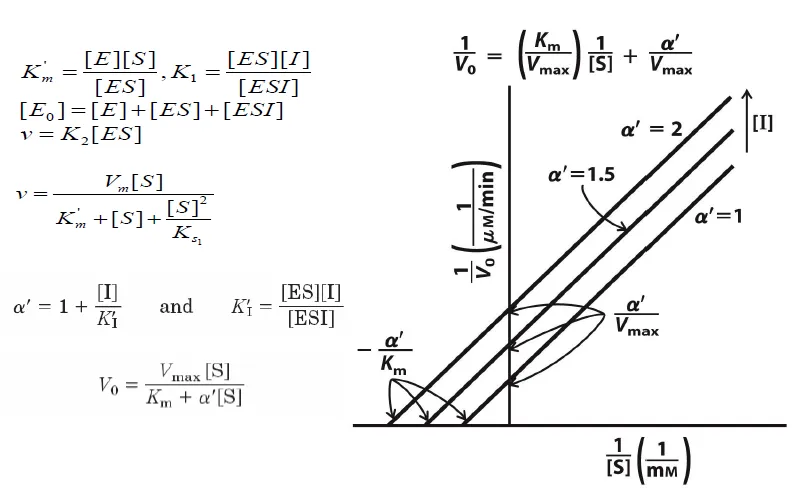
이 때 lineweaver-burk plot을 그려보면 위와 같이 기울기는 같고 x, y절편만 I 농도에 따라 달라지는 결과를 얻을 수 있음.
마지막으로 mixed inhibitor에 대해 알아보자.
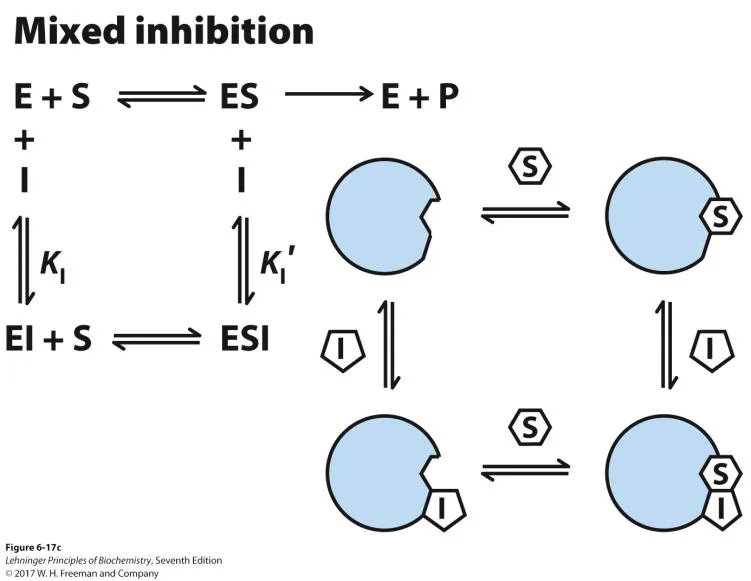
이 경우 competitive inhibition적인 특성도 보이면서 uncompetitive inhibition적인 특성도 보이게 됨. 위 그림을 보면 실제로 inhibitor가 그냥 enzyme에 붙어 substrate와 경쟁하는 역할을 할 수도 있고, 이미 substrate에 붙어있는 상태의 enzyme에 붙어서 catalytic activity를 낮춰주는 역할을 할 수도 있음.
그러다 보니 Vmax가 감소하고 KM도 변하게 됨.
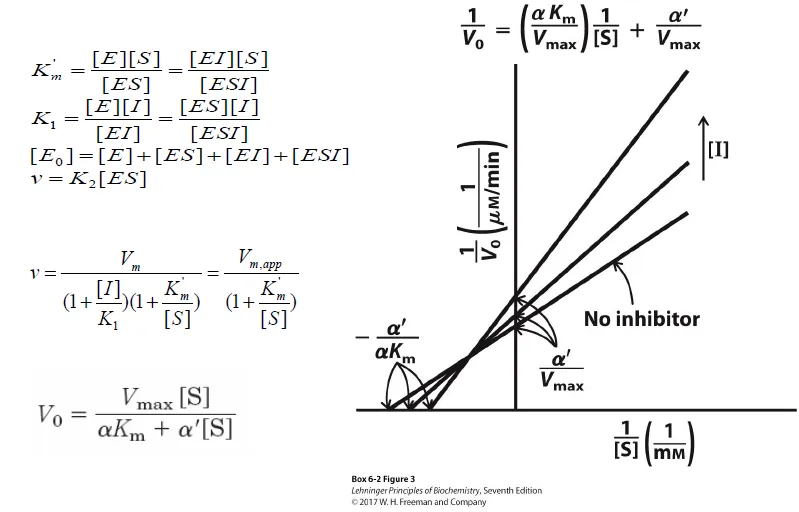
더 나아가 Lineweaver-Burk plot을 그려볼 시 y axis로부터 왼쪽 부분에서 intersect가 나타나게 됨.
참고로 이 때 α=1이 되면 uncompetitive inhibitor가 되고 α'=1이 되면 competitive inhibitor가 됨.
+) noncompetitive inhibitor는 competition은 하지 않지만 inhibition은 하는 녀석임. 이 녀석은 uncompetitive inhibitor(비경쟁적 저해제)와는 조금 다른 개념임.
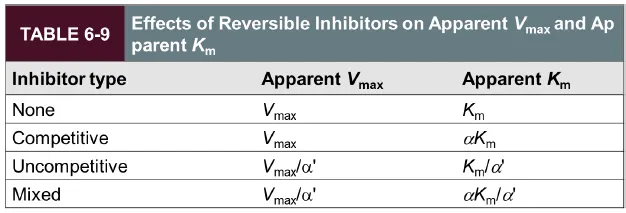
위 그림에는 competitive, uncompetitive, mixed inhibitor 각각에서의 Vmax, KM 값이 어떻게 변하는지를 정리해주고 있으므로 참고할 것.
다음 포스트에서는 효소의 조절에 대해 알아보자.
'전공자를 위한 생물학 > 생화학' 카테고리의 다른 글
| [생화학] 6.1 : 단당류(monosaccharide) - 1 (0) | 2024.11.07 |
|---|---|
| [생화학] 5.6 : 효소 반응의 조절 (0) | 2024.11.07 |
| [생화학] 5.5 : 효소의 kinetics - 2 (0) | 2024.11.07 |
| [생화학] 5.5 : 효소의 kinetics - 1 (0) | 2024.11.07 |
| [생화학] 5.4 : 펩티도글리칸과 라이소자임(peptidoglycan and lysozyme) (0) | 2024.11.07 |