지난 포스트에 이어서 클로닝에 대해 조금 더 알아보자.
이제 cloning vector에 대해 알아보자. 일단 대표적인 cloning vector에는 plasmid가 있음. plasmid는 circular한 DNA이며 일반적으로 negative supercoil을 가지는 intact한 form으로 존재함. 이 녀석은 원래 bacterial genomic DNA의 일부로 존재했는데, 이를 separate해서 사용하게 된 것임.
이들은 origin of replication을 가지기 때문에 host cell에 들어갈 시 자체적으로 replicate하는 것이 가능하며, 보통은 selection을 위해 antibiotic resistance gene을 가지고 있음. 이들의 경우 보통 15,000bp정도 size의 DNA를 cloning할 수 있음. 이 때 15,000bp의 size는 단백질로 따지면 대략 3000개의 amino acid로 이루어진 단백질인데, 이정도면 꽤 큰 protein까지의 range와 겹침. 따라서 대부분의 protein들은 plasmid만으로도 cover가능함.
한편 아예 whole chromosome을 cloning하고자 할 때(300,000bp 이상의 size)는 bacterial artificial chromosome(BAC), 혹은 yeast artificial chromosome(YAC)을 사용함.

위 그림은 plasmid를 보여주고 있음. 보면 실제로 다양한 restriction site를 가지고 있으며, 항생제 저항성 gene도 가지고 있고, replication origin을 가지고 있고, 전체적인 형태가 circular함. 이에 더해 위 그림 오른쪽 plasmid의 경우 lacZ gene의 5' 부근에 MCS site를 가지고 있음을 알 수 있음. 그리고 lacZ의 발현을 위해서 lacZ gene 앞에 promoter까지 포함되어있는 것을 알 수 있음.
참고로 위 그림 오른쪽의 plasmid인 pUC18은 size가 작아서 transfection 효율도 좋다보니 보통 transfection할 때 control로 많이 사용함.

다음으로 위 그림은 BAC을 나타내주고 있음. 보면 이 경우 기본적인 vector system에 bacteria chromosome의 일부분을 삽입해줘서 만들게 됨. 이 경우에도 cloning하는 방식은 완전히 동일하며, ori site, 항생제 저항성 site등은 다 존재함. 다만 이 경우 lacZ의 MCS 부근에 bacteria chromosome의 large fragment를 삽입해서 일반 plasmid size보다 훨씬 큰 vector system을 만들게 됨. 이 때 이 녀석이 bacteria 내에서 제대로 존재할 수 있도록 bacteria 내에서 BAC plasmid의 copy number가 적게 유지되게끔 하는 sequence를 삽입해서 control해주게 됨. 이후 항생제 저항성 gene이 삽입된 녀석만을 골라주기 위해 항생제가 포함된 배지에서 배양해주고, 이후 lacZ system을 이용해 BAC이 잘 recombination되어서 lacZ가 고장난 white colony만을 pick해주게 됨.

위 그림은 YAC을 나타내주고 있음. yeast를 포함한 eukaryote의 경우 chromosome 양 끝에 telomere sequence가 있음. 이 sequence를 실제로 위 그림 위와 같이 집어넣어주고, telomere sequence 안쪽으로 잘라 linearize하게 됨. 이후 제한효소를 이용해 cut한 다음 위 그림 가운데와 같이 yeast gene, 즉 YAC를 삽입해주게 됨. 이후 이 녀석을 yeast 내부에 넣어주게 되면 이 vector는 yeast의 유전 system을 이용해 복제될 수 있을 것임. 참고로 이 때 실제로 YAC가 들어간 yeast만을 선별하기 위해 X gene을 삽입해줌. 이 때 이 X는 특정 물질에 대한 de novo synthesis를 가능하게 해줌. 가장 대표적인 것이 histidine으로, 배지에 His가 부족한 환경을 조성해줄 시 이 X가 있는 yeast만 잘 살아남을 것임. (이처럼 특정 영양소 부족 환경에서 살아남지 못하는 경우를 auxotroph라고 함)
다음으로 expression vector에 대해 알아보자. 이 때 expression vector란 gene으로부터 만들어지는 protein 발현산물까지를 보고자 할 때 사용하는 vector임.

위 그림은 typical한 expression vector를 보여주고 있음. 보면 이 경우 당연히 gene이 전사되어야 하므로 promoter가 포함되어 있고, mRNA가 만들어질지 만들어지지 않을지와 관련된 control region인 operator도 포함되어 있으며, 만들어진 mRNA 중 ribosome이 결합될 수 있는 ribosome-binding site(eukaryote의 경우 Kozak sequence, prokaryote의 경우 shine-dalgarno sequence)도 넣어주게 됨. 참고로 이 때 polylinker는 MCS와 동일한 개념임. 그리고 만들어진 mRNA가 일정 수준에서 termination된 채로 존재해야 하므로 transcription-termination sequence도 vector에 포함되어 있음.

위 그림은 bacteria를 이용해 eukaryotic protein을 합성할 때 가장 많이 사용하는 pET vector system을 보여주고 있음. pET는 plasmid이고, 이 plasmid 안에는 T7 phage로부터 유래한 RNA polymerase가 딱 결합할 수 있는 T7 promoter가 존재함. 보면 E.coli gene 중 DE3 zone을 genetic modification을 이용해 인위적으로 bacteria chromosome 내부에 삽입해 놓았음. 이 zone 안에 T7 gene 1을 넣어놓았는데, 이 gene으로부터 만들어지는 것이 바로 T7 promoter 뒤에 있는 gene의 전사를 진행시킬 수 있는 T7 RNA polymerase임.
그런데 일반적인 상황에서는 E.coli RNA polymerase가 작용하므로 T7 RNA polymerase가 작용하지 못함. 그러다가 inducer의 일종인 IPTG가 외부에서 들어오게 되면 이 녀석이 DE3 region에 작용하게 됨. 구체적으로 DE3 region에는 lacO 부위가 존재하는데 여기에 원래는 lac repressor가 달라붙어있어서 transcription이 억제되고 있음. 그런데 IPTG가 들어가면 이 녀석이 lac repressor와 결합하면서 lacO에서 lac repressor가 떨어지게 됨. 그 결과 T7 RNA polymerase가 만들어지고 이 녀석이 T7 promoter에 결합해 pET vector 내부에 있는 target gene으로부터 protein이 만들어지게 됨.
이런 system은 일반적인 상황에서는 target gene이 발현하지 못하도록 하다가 IPTG가 가해졌을 때만 target gene이 발현되도록 control하게 해주는 system임.
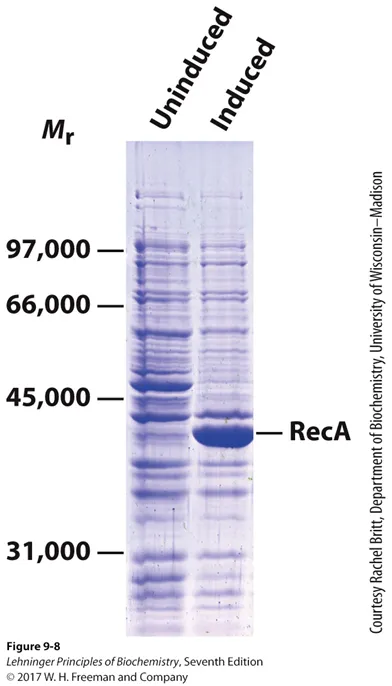
위 자료는 실제로 IPTG induction에 의해 induced될 시 RecA 단백질의 양이 엄청나게 증가하는 것을 보여주고 있음. 다만 이 자료만으로는 RecA가 제대로 folding되어서 functional한지는 알지 못함. 만약 bacteria에서 발현된 RecA가 제대로 folding되지 않았다면 folding을 위한 추가적인 step을 거쳐야 할 것임.
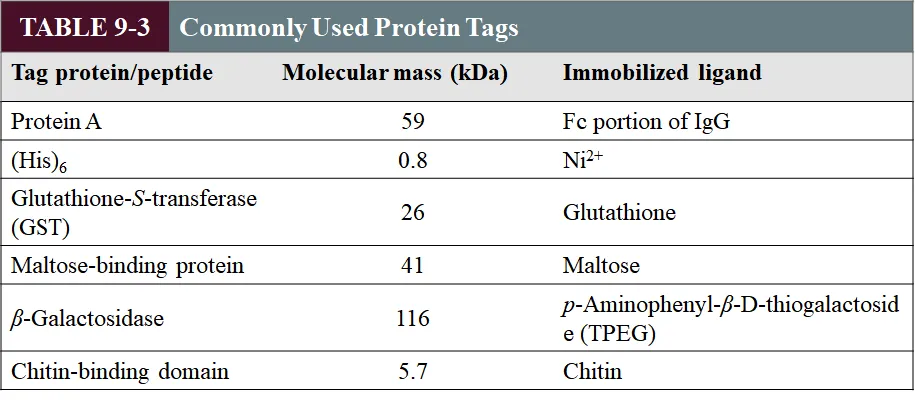
한편 recombinant gene으로부터 만들어지는 단백질 산물을 purify하기 위해서 recombinant gene 앞, 혹은 뒤에 우리가 쉽게 분리할 수 있는 tag에 해당하는 유전자를 삽입해주게 됨. 위 표에는 흔히 많이 사용되는 tag의 종류들이 나타나 있으므로 참고할 것.
이 때 tag protein이라 적혀있는 부분은 말 그대로 특정한 단백질을 tagging해주는 역할을 하고, 각 tag에 대해 affinity chromatography를 수행할 때는 위 그림 오른쪽과 같이 특정 ligand들이 immobilize되어있는 resin을 사용해주게 됨.
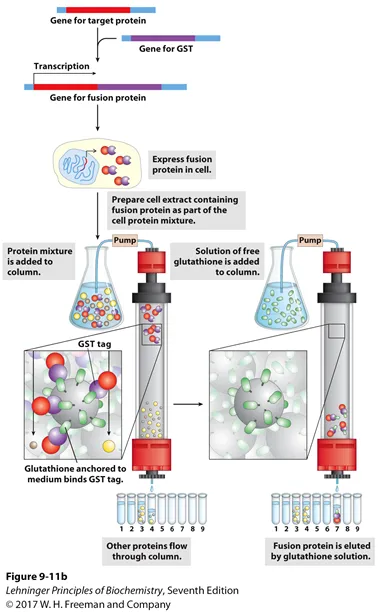
위 그림은 이 과정을 실제로 나타내 보여주고 있음. 보면 특정 protein과 tag가 fusion될 시 affinity chromatography 결과 bead에 protein of interest만 걸려들 것임. 이후 bead에 immobilize되어있는 ligand들을 buffer 형태로 추가적으로 통과시켜줄 시 competition에 의해서 결국 위 그림 오른쪽과 같이 protein of interest도 분리할 수 있음.
다음 포스트에서는 PCR에 대해 알아보자.
'전공자를 위한 생물학 > 생화학' 카테고리의 다른 글
| [생화학] 8.2 : PCR - 2 (0) | 2024.11.09 |
|---|---|
| [생화학] 8.2 : PCR - 1 (0) | 2024.11.09 |
| [생화학] 8.1 : DNA 클로닝(cloning) - 2 (0) | 2024.11.09 |
| [생화학] 8.1 : DNA 클로닝(cloning) - 1 (0) | 2024.11.09 |
| [생화학] 7.10 : DNA 시퀀싱(DNA sequencing) - 3 (0) | 2024.11.09 |