이번 포스트에서는 DNA, 혹은 단백질을 분리할 수 있는 실험방법들에 대해 알아보도록 하자.
분자생물학적인 실험을 진행하다보면 종종 protein, nucleic acid와 같은 녀석들의 mixture(혼합물)가 얻어짐. 이 때 protein은 cellular extract로부터 정제되어야 비로소 연구에 사용 가능함. 또한 nucleic acid의 경우에도 purify가 필요함.
protein, nucleic acid 등을 분리하기 위해 사용되는 대표적인 방식이 gel electrophoresis(전기영동)임.
DNA electrophoresis
gel electrophoresis를 이용해서 DNA를 분리하고자 할 때는 녹은 agarose를 적당한 농도로 굳힌 것을 gel로 사용함. 한편 제거 가능한 comb(sample을 넣어줄 수 있는 홈을 만들어줌)에 이 agarose를 넣고 굳히게 되면 아래 그림과 같이 DNA를 처음 loading할 수 있는 공간이 생김.

위 그림과 같이 공간에 DNA sample을 넣은 후 전극을 위 그림 (a)와 같이 위치시켜준후 neutral(중성)한 pH 환경하에서 run시켜주게 되면 DNA는 backbone 내의 인산기에 의해 음전하를 띄므로 +극을 향해 내려오게 됨. 이 때 size에 따라 내려오는 속도가 달라지므로 이를 이용해서 size별로 DNA를 분리할 수 있게 됨. (보통 이 방법으로는 15분 ~ 1시간에 걸쳐서 DNA를 running시켜줌) 이 때 당연히 짧은 길이의 DNA 조각수록 같은 시간동안 내려오는 거리는 더 길 것임.
그런데 이 때 DNA를 staining해야 어느 곳까지 내려왔는지를 관찰할 수 있으므로 dye를 사용해야 함. 과거에는 ethidium bromide라는 DNA 사이에 끼어들어갈 수 있는 물질을 표지물질로 많이 사용했는데, 이 녀석의 경우 암을 유발하므로 매우 위험했었음. 그러나 최근에는 독성이 크지 않은 fluorescent dye가 많이 등장해서 이러한 문제가 덜해짐. (그럼에도 불구하고 DNA 사이에 무언가가 끼어들어가서 염색하는 원리인 것은 동일하므로 여전히 주의해야 함)

한편 gel electrophoresis를 통해 분리한 DNA fragment들의 size를 구체적으로 알고자 할 경우 위와 같이 미리 크기가 알려진 standard fragment와 함께 run시켜서 비교하는 과정을 거치면서 size를 추정함.
한편 직전에 설명한 방법으로는 기껏해야 10kbp정도의 DNA fragment를 분리해내는 것이 최선임. 그렇다면 이보다 더 큰 size의 DNA에 대해 electrophoresis를 수행하고자 할 때는 어떤 방법을 사용해야 하는가. 이 때는 pulsed-field gel electrophoresis(PFGE)라는 방법을 사용하면 됨.

위 그림에 PFGE의 모식도가 나타나 있음. 이 방식의 경우 18~24시간 정도가 소요되며, 매우 오랜 시간이 소요되기에 이 과정에서 gel이 녹을 우려가 있어 14도 정도의 온도에서 수행하여야 함. 한편 이 녀석의 이름에서 알 수 있듯 이 녀석은 특정 주기마다 pulse를 주어서 위 그림 왼쪽 안에서 오른쪽에 위치한 + 전극과 왼쪽에 위치한 + 전극이 서로 번갈아가며 켜졌다 꺼졌다를 반복함. (이 때 두 전극 사이의 각도가 120도임) 그러면 DNA 조각이 지그재그형으로 내려가다가 결국에는 오른쪽 그림과 같이 잘 분리되게 됨. 이 방법을 이용하면 1.5mbp 크기의 DNA까지도 분리해낼 수 있음.
SDS-PAGE
힌편 gel electrophoresis를 이용해 단백질을 분리할 수도 있는데, 이 경우에는 polyacrylamide를 gel로 사용함. 그렇기에 이 방식을 polyacrylamide gel electrophoresis(PAGE)라고 부름.
그런데 DNA와 달리 단백질은 가지고 있는 전하가 그 종류에 따라 다양함. 따라서 오로지 size에 의해서만 단백질을 분리하고 싶다면 이들의 각양각색의 전하를 통일해줘야 함. 이를 위해 음전하를 띄고 있는 sodium dodecyl sulfate(SDS)라는 녀석으로 단백질 전체를 코팅해줌. 이 상태가 되면 전는 통일되게 됨.

이후 DNA를 분리할 때와 마찬가지 방식으로 electrophoresis를 시행해주면 위와 같이 단백질이 분리됨.
이러한 과정 전체를 SDS-PAGE라고 불러줌.
한편 SDS-PAGE만으로는 단백질을 적절히 분리해내지 못하는 경우가 있을 수 있음. 이 때 해상도를 높이기 위해 사용할 수 있는 방법이 바로 two-dimensional gel electrophoresis(2D gel electrophoresis)임.
이 방법은 크게 두 단계로 이루어져 있음. 우선 첫 번째 단계에서는 isoelectric focusing gel을 이용해 protein을 우선 한 번 분리해줌. 이 때의 분리 원리에 대해 간단히 알아보자. 모든 단백질은 각기 다른 전하를 가지고 있고, 이에 따라 서로 isoelectric point(PI)가 다름. (이 때 isoelectric point란 charge를 더이상 띄지 않게 되는(neutral해지는) pH값을 의미함) 따라서 각기 다른 단백질들이 모두 isoelectric focusing gel(위치에 따라 pH가 연속적으로 달라지게 setting) 위에서 나아가다가, 각기 자신의 isoelectric point에 도달하게 되면 neutral해지게 되어서 전류가 흘러도 더이상 이동하지 않게 됨.
이후 이 gel을 90도 돌린 후 앞서 본 polyacrylamide gel 위쪽에 붙여주어 SDS-PAGE를 진행함. 그럴 시 protein을 isoelectric point(charge), size에 따라 분리할 수 있게 되며, 결과적으로 아래와 같은 결를 얻을 수 있음.

(가로는 charge에 따른 분리, 세로로는 size에 따른 분리)
이 방법을 사용하면 특정 tissue에서 물질을 처리해준 sample, 처리해주지 않은 sample 등의 비교를 통해 물질에 의해 발현이 증가된 단백질을 찾아내는 등의 연구를 진행할 수도 있음. (저기서 나타난 protein들 중 관심이 있는 protein이 있으면 그 부분의 gel을 파낸 후 그 안에 포함된 protein을 MS 등의 방법을 이용해 추가적으로 분석할 수도 있음)
chromatography (크로마토그래피)
다음으로 chromatography(크로마토그래피)에 대해 알아보자.
우선 여기서 말하는 chromatography는 모두 column에 특정 resin(column 내에 들어가는 일종의 bead)을 넣어준 후 수직 방향으로 protein sample을 fraction별로 분리시키는 방식임.
ion-exchange chromatography는 protein의 charge에 따라 분리하는 방법임. 이 때 사용되는 resin은 charge를 가진 녀석(이 경우 protein)과 결합하는 특성을 가지고 있음. 이후 전체 column에 걸쳐 서서히 조금씩 증가하는 Ionic strength를 가지도록 차등적인 농도로 buffer를 처리해주게 되면, protein이 가지고 있는 전하에 따라 각기 다른 fraction에 걸쳐서 protein이 분리됨.
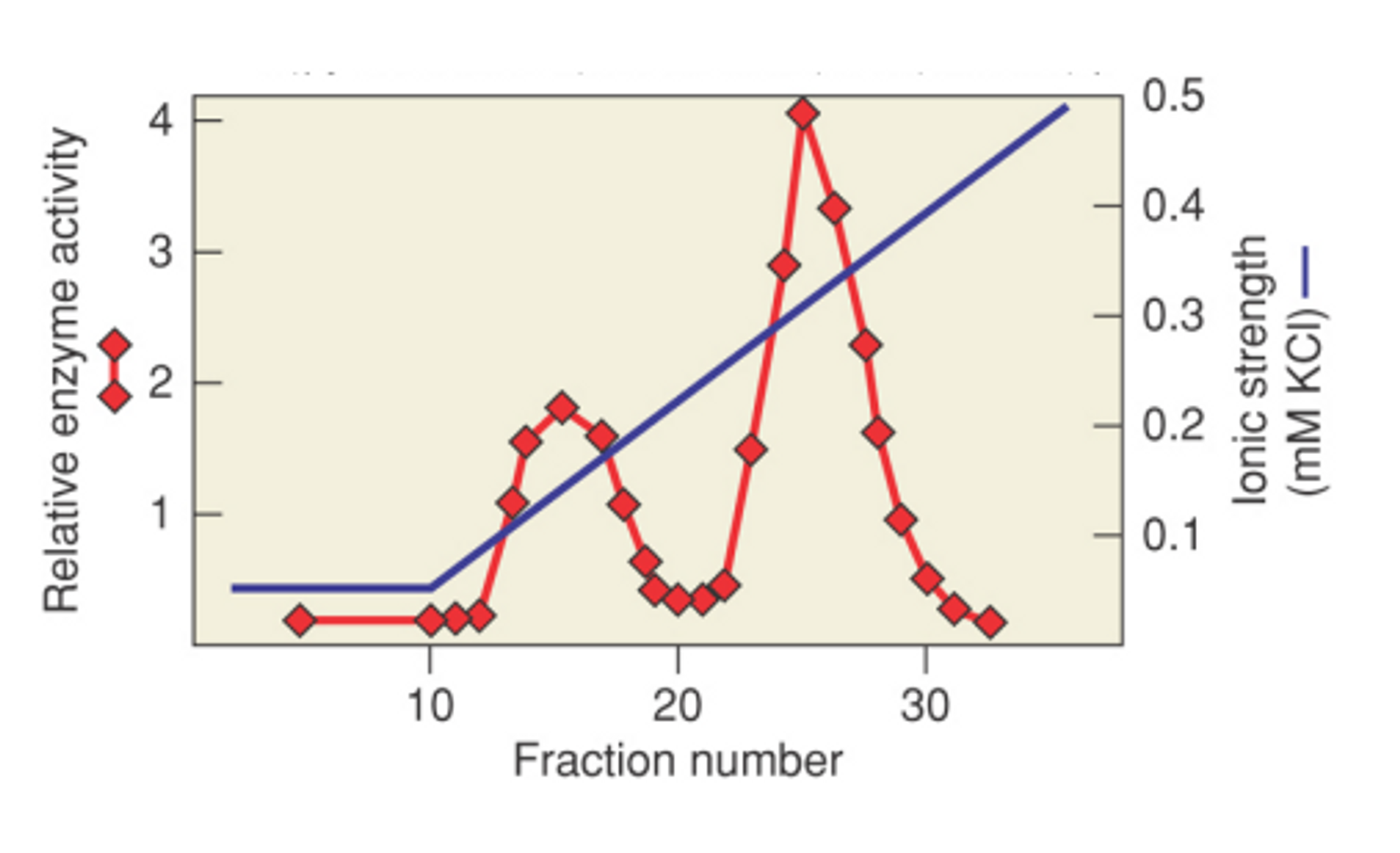
위 그림에 앞서 글로 표현한 것들이 graph로 표현되어 있음. 한편 분리가 끝난 이후 별도로 우리가 관심 있어하는 protein이 어디에 분리되어 있는지를 확인하기 위해 enzyme activity를 본 결과 특정 fraction에서만 이 protein들이 많이 분리되었음을 확인할 수 있음. 이후 이 녀석들만 뽑아서 실험에 활용할 수 있음.
다음으로, gel filtration chromatography의 경우 protein을 size에 따라 분리할 수 있음. 이 때 사용되는 resin은 특이한데, 아래와 같은 모양을 하고 있음.
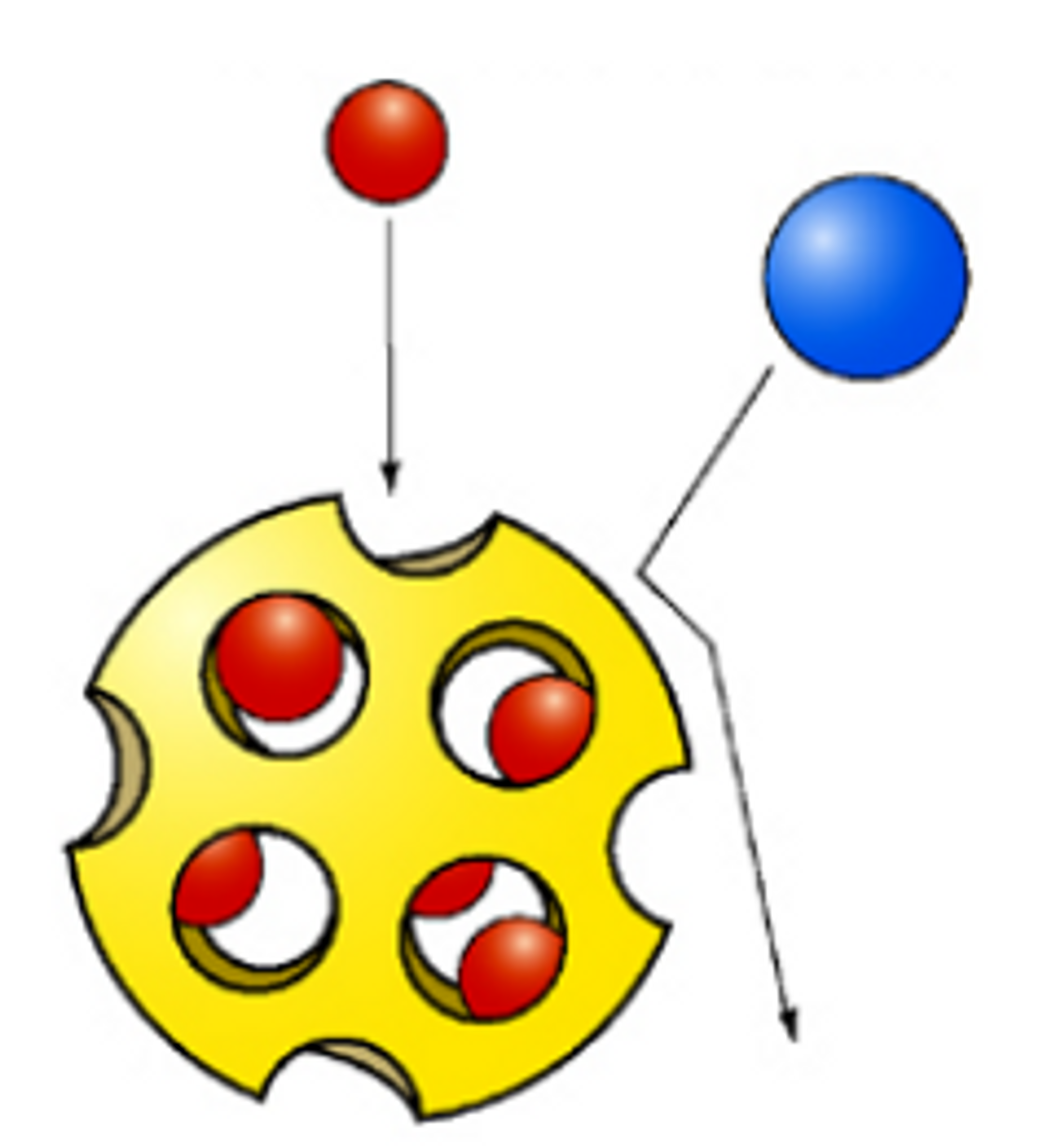
위 그림에서도 나타나 있듯 resin 안에 작은 구멍이 뚫려 있어서 작은 protein 분자는 이 구멍 안으로 들어갔다 빠져나가게 됨. 그러다 보니 작은 protein분자일수록 가라앉기까지 더 오랜 시간이 소요되어서 큰 protein부터 분리됨.
마지막으로 affinity chromatography의 경우 resin에 우리가 관심 있는 protein과 상호작용할 수 있는 어떤 녀석을 부착시켜 놓은 후 sample을 넣어서, resin 표면에 부착된 녀석과 상호작용할수 있는 녀석 외의 나머지 녀석들을 다 미리 가라앉혀버리는 방법임. 이후 elution buffer 등을 처리해서 결합되어있던 protein들은 따로 얻어낼 수 있음.
2020.12.18 - [전공자를 위한 생물학/세포생물학] - [세포생물학] 1.2 : 단백질의 정제 - 원심분리 & 크로마토그래피
[세포생물학] 1.2 : 단백질의 정제 - 원심분리 & 크로마토그래피
이번 포스트에서는 단백질을 정제하는 방법에 대해 알아보려고 해요. 아니, 앞에서 계속 세포 이야기만 하다가 갑자기 뜬금없이 단백질?? 하고 생각하시는 분들도 있겠지만.. 결국 세포 내에 존
unicellular.tistory.com
크로마토그래피와 관련된 보다 더 자세한 설명은 위 세포생물학 포스트를 참고하자.
다음 포스트에서는 특정 DNA, 혹은 단백질 등을 시각화하기 위해 라벨링하는 각종 방식들에 대해 알아보도록 하자.
'전공자를 위한 생물학 > 분자생물학' 카테고리의 다른 글
| [분자생물학] 5.3 : hybridization (혼성화) - 서던 블롯, DNA 지문분석, in situ 혼성, 웨스턴 블롯 (0) | 2023.06.25 |
|---|---|
| [분자생물학] 5.2 : radioactive, nonradioactive tracer (0) | 2023.06.24 |
| [분자생물학] 4.3 : expression vector (발현 벡터) - baculovirus, Ti plasmid (1) | 2023.06.24 |
| [분자생물학] 4.2 : PCR, RT-PCR, real-time PCR (0) | 2023.06.24 |
| [분자생물학] 4.1 : cloning (클로닝) - genomic library, cDNA cloning, RACE (0) | 2023.06.24 |