이번 포스트에서는 단백질을 실제로 세포 내에서 발현시키고자 할 때 사용되는 expression vector (발현 벡터)에 대해 알아보도록 하자.
실제로 cloning 기술을 이용해서 실제로 단백질 product를 합성하는 것에 대한 연구도 활발히 수행되고 있음. 이 때 단백질 합성의 목적은 또 다른 연구에 사용하기 위해서일수도, 상업적으로 이용하기 위해서(대표적인 예가 인슐린)일수도 있음.
단백질 합성을 목적으로 하는 cloning에서는 expression vector라는 특수한 vector를 사용함. 이 때 expression vector는 매우 강한 promoter를 사용하므로 엄청난 수율의 단백질 합성물을 얻어낼 수 있음.
그러나 무조건 단백질을 엄청 많이 합성한다고 해서 마냥 좋은 것은 아님. 크게 아래와 같은 단점들이 있음.
1) bacteria 내에 과량의 eukaryotic protein이 쌓이게 되면 이들은 대체로 독성을 띔.
2) eukaryotic protein의 누적 세균의 생장을 저해함.
3) 발현된 과량의 단백질들은 insoluble aggregate(물에 녹지 않는 덩어리)가 되기도 함. 이 때 이 aggregate를 inclusion body라 부름.
이러한 문제점 해결을 위해 우리가 원할 때만 많은 양의 단백질이 발현되도록 해주는 vector가 바로 inducible expression vector임. 이 vector는 lac promoter, trp promoter, ara promoter와 같은 promoter를 가짐. 이 때 lac promoter는 IPTG가 처리되었을 때만 활성화되고, ara promoter는 arabinose를 처리해 주었을 때만 활성화되기에, 배양 조건을 변화시킴에 따라 우리가 원하는 시점에 발현을 개시해줄 수 있음.
그렇다면 일단 bacteria가 합성한 protein 중 우리가 원하는 protein만을 어떻게 분리할까.

이 때 사용되는 대표적인 방법이 위에 제시되어 있음. 이때 우리가 원하는 단백질이 노란색으로, 원래 bacteria가 생산하는 단백질이 초록색으로, purify에 도움을 주는(이 경우 oligohistidine) 단백질 tag 부분이 빨간색으로 표시되어 있음.
이 때 빨간색과 노란색이 결합되어 있는 것에 주목하자. 한편 oligohistidine은 Ni2+ bead에 대해 high affinity를 가짐. 따라서 위 그림의 파란 부분에 Ni2+ bead를 위치시키게 되면, 우리가 원하는 단백질이 포함된 부분만 bead에 잡히게 되고 나머지 단백질들은 모두 아래로 빠져나감. 이후 elution buffer(일반적으로 histidine 또는 histidine 유도체인 이미다졸을 사용)를 써서 Ni2+ bead과 oligohistidine을 때주게 되면 우리가 원하는 단백질만을 얻어낼 수 있음.
이 때 oligohistidine이 포함된 전체 단백질을 그냥 사용하는 경우도 있고 enterokinase를 이용해 oligohistidine을 잘라낸 후 노란색 부분만 사용하는 경우도 있음. (물론 노란 부분만 얻어내기 위해 다시 한 번 더 Ni2+ bead가 포함된 column에 통과시켜주어야 함)
그러나 eukaryotic protein을 bacterial system에서 발현시키는 것은 아래와 같은 문제점을 발생시킬 수 있음.
1) bacteria가 합성된 protein을 외래물질로 인식하고 파괴해버릴 수 있음.
2) post-translational modification(PTM)이 bacteria와 eukaryote 사이에서 서로 다름. (실제로 bacteria에서는 glycosylation이 전혀 일어나지 않음)
3) bacteria 내에서 적절한 protein folding(단백질 접힘)이 유발되지 않을 수 있음. (그리고 적절치 못하게 접힌 protein은 기능을 제대로 할 수 없을 뿐 아니라 insoluble aggregate를 형성할 수도 있음)
이러한 박테리아에서의 발현 과정에서 발생하는 문제를 해결하기 위한 방안으로써 gene을 eukaryotic cell에서 발현시키는 방법이 많이 연구되었음. 이 때도 물론 initial cloning은 E. coli와 같은 원핵생물에서 수행한 후, 이를 다시 eukaryotic cell로 옮겨 발현시키는 방식을 사용할 수 있음. 이런 상황에서 E. coli를 shuttle vector라 부름.
이 때 사용할 eukaryotic cell은 일반적으로 우리가 머릿속에 떠올리는, plate에서 배양시키는 녀석들이 아님. plate에서 배양되는 cell들의 경우 많은 단백질을 얻기 위해서 몇 개의 plate가 필요할지 모름.
가장 흔히 사용되는 eukaryotic cell은 yeast(효모)임. yeast는 매우 빠른 성장과 배양의 용이성 뿐 아니라 post-translational modification(PTM)에 있어 적절한 환경을 제공함.
그러나 yeast의 wall이 매우 두껍기 때문에 wall을 깨서 protein을 취하기가 어려움. 그러다 보니 아예 서열을 삽입해 줄 때 export signal peptide 서열도 같이 삽입해주어서 yeast가 완성된 protein을 growth medium으로 분비하도록 함.
bacteria의 경우 우리가 원하는 DNA를 삽입해주는 과정을 transformation이라 불러줬다면 animal cell의 경우 이 과정을 transfection이라 불러줌.
transfection은 크게 세 가지 방법으로 유도됨.
1) using calcium phosphate
: 이 방법의 경우 cell을 DNA+phosphate buffer에 넣어준 후 calcium salt solution을 첨가해서 precipitate(검은 알갱이들)를 형성하게 함. 그러면 precipitate를 세포가 endocytosis(집어삼킴)하게 되고, 이 과정에서 DNA도 같이 세포 내로 들어가게 됨.
2) using liposome
: liposome 내부에 DNA를 첨가한 후 liposome이 cell membrane과 fusion될 때 DNA도 세포 내부로 같이 넣어주는 방식.
3) electroporation
: 전기충격을 가해 세포 내로 DNA가 유입되게끔 하는 방식.
한편, 단백질 생산을 위해 많이 사용되는 세포들 중 동물세포 외에 곤충세포도 대표적임. 이 때 핵심적인 것이 바로 baculovirus임.
baculovirus의 경우 130kbp정도의 매우 큰 circular DNA를 가지고 있음. 이 사이에 우리가 원하는 DNA를 끼워넣어준 후 cell(주로 곤충 세포)에 감염시켜 주게 되면 우리가 원하는 protein을 대량으로(1L의 medium 당 0.5g의 protein을 생산할 수 있음) 만들어낼 수 있음.
이 때 baculovirus의 essential(감염, 복제능을 유발하는) gene의 경우 모두 제거해준 상태로 감염시켜주기에, 이후 virus의 감염능은 사라지게 됨.
한편 이 때 단백질의 생산량을 엄청나게 증가시켜주는 요인이 무엇인지에 대해 궁금할 수도 있는데, baculovirus 내부의 promoter인 polyhedrin promoter는 매우 강력하기에 단백질을 엄청나게 많이 만들어낼 수 있게 됨.
그 밖에 plant(식물)을 대상으로도 유전자 삽입이 가능함.
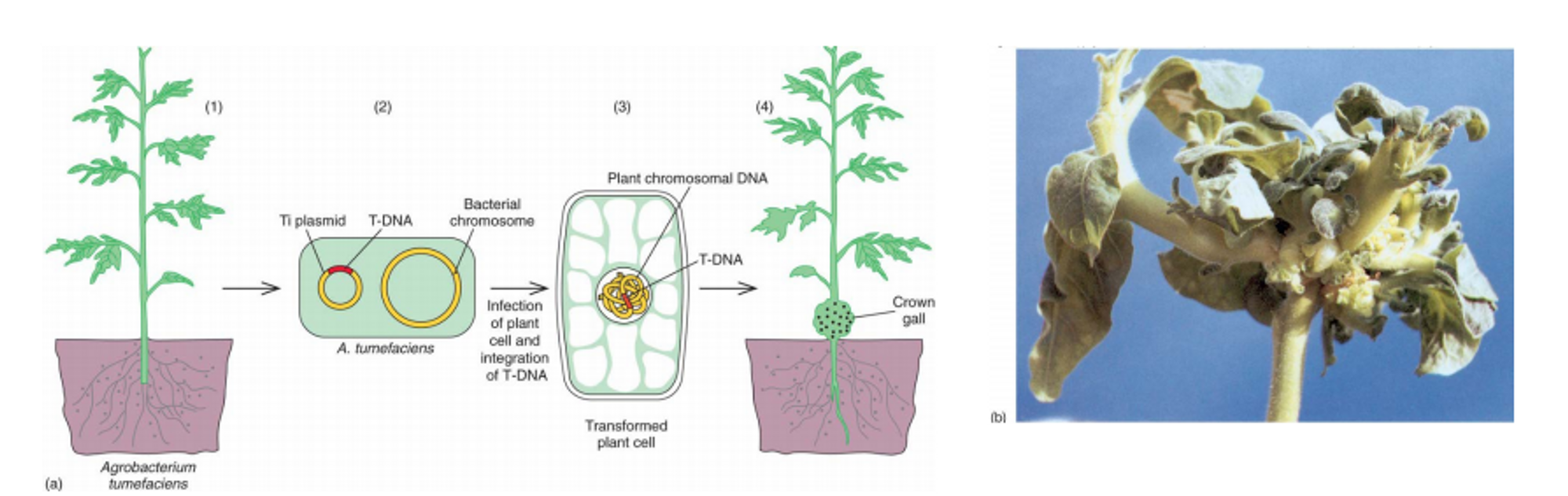
이에 대한 아이디어는는 plant에 감염되어 Crown gall(kind of tumor)을 형성시키는 A. tumefaciens라는 bacteria로부터 얻음. 위 그림을 보면 A. tumefaciens는 Ti plasmid를 가지고, A. tumefaciens가 식물에 감염될 시 Ti plasmid 내부의 T-DNA가 plant의 chromosome 내에 삽입. 그 결과 A. tumefaciens가 자라는 데 필요한 여러 물질들의 합성이 유도됨.
따라서 이 Ti plasmid를 이용하면 식물에 우리가 원하는 gene을 넣어 발현시킬 수 있겠다는 생각에 이르게 되었고, T-DNA를 때낸 후 우리가 원하는 유전자를 삽입하여 식물에 transformation시켜 보았음.
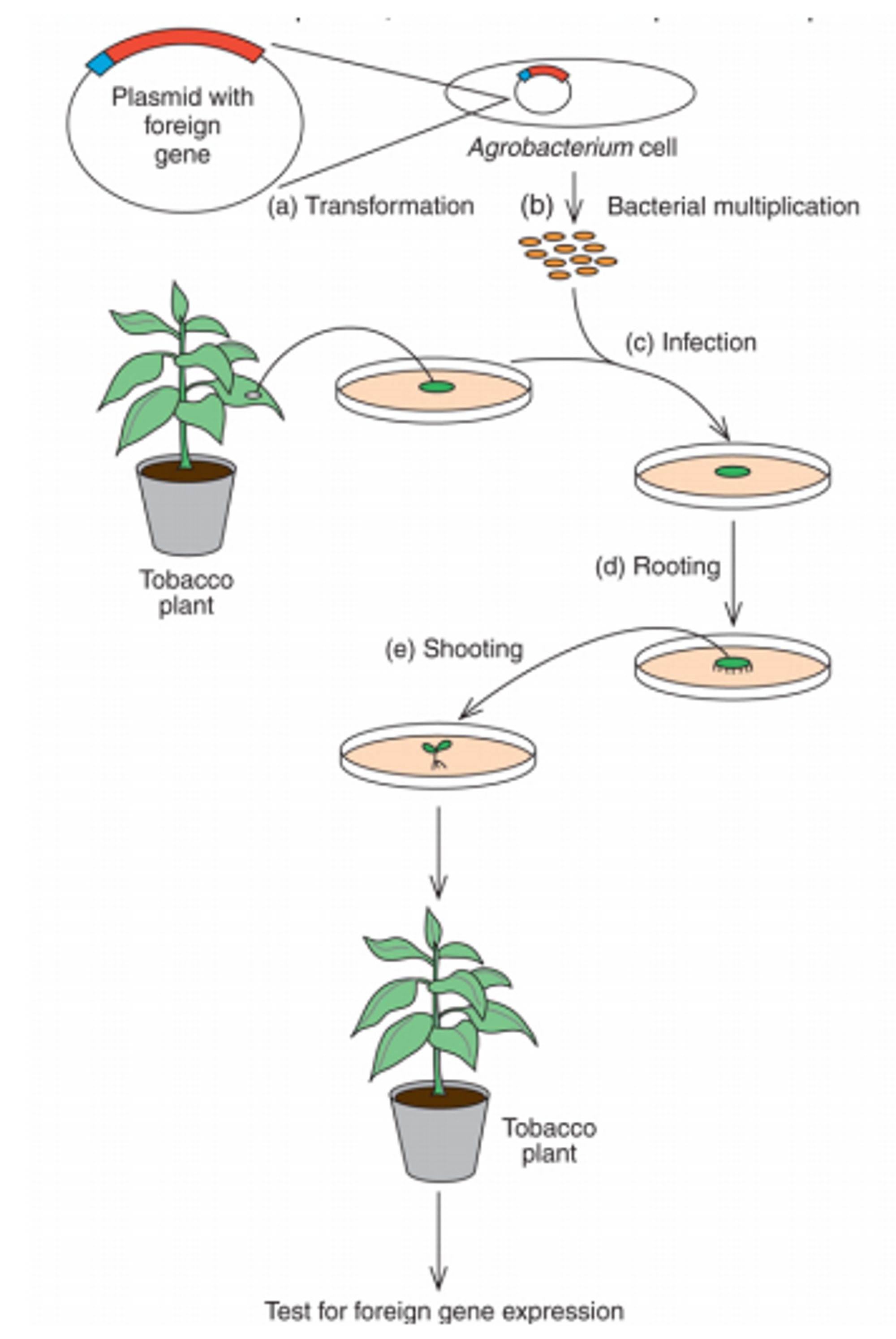
plant의 transformation 과정이 위 그림에 나타나 있음. 그럼 이러한 기술은 어떻게 활용될 수 있을까. 예를 들어 Ti plasmid를 이용해 제초제 저항성 gene을 삽입시켜 줄 시 제초제를 식물에 처리해줘도 식물은 죽지 않고 해충들만 박멸시킬 수 있음.
다음 포스트부터는 유전자와 유전자의 활성에 대해 알아보기 위해 분자생물학에서 주로 사용하는 실험 기법들에 대해 알아보도록 하자.
'전공자를 위한 생물학 > 분자생물학' 카테고리의 다른 글
| [분자생물학] 5.2 : radioactive, nonradioactive tracer (0) | 2023.06.24 |
|---|---|
| [분자생물학] 5.1 : DNA 전기영동, SDS-PAGE, chromatography(크로마토크래피) (0) | 2023.06.24 |
| [분자생물학] 4.2 : PCR, RT-PCR, real-time PCR (0) | 2023.06.24 |
| [분자생물학] 4.1 : cloning (클로닝) - genomic library, cDNA cloning, RACE (0) | 2023.06.24 |
| [분자생물학] 4.1 : cloning (클로닝) - vector (벡터) (3) | 2023.06.24 |