이번 포스트에서는 버퍼(buffer)에 대해 알아보자.
buffer는 weak acid과 이에 대한 conjugate base의 혼합물로 구성되어 있으며, pH가 확확 바뀌는 것을 막아주는 역할을 수행함.
이 때 buffer의 buffering capacity가 실제로 buffer 역할을 제대로 수행할 수 있을 만큼 커지는 지점을 알기 위해서는 pH = pKa가 되는 point를 잘 살펴봐야함.

위 그림과 같은 반응을 가정했을때, Ka는 위 그림 오른쪽 위와 같이 나타낼 수 있음. 한편 이 식을 다시금 [H+]에 대해 정리한 후 양 변에 -log를 씌워주게 되면 결국 pH = -logKa -log([HA]/[A-])라는 식이 얻어지게 됨. 그런데 이 때 만약 [HA] = [A-]가 되면, 즉 weak acid와 이의 conjugate base 농도가 서로 같아지게 되면 이 point에서 pH = pKa가 됨. 이 지점에서 buffering capacity가 최대가 됨.

위 graph를 보면 첨가된 OH- 양에 따라서 pH가 얼마나 변화하는지가 나타나 있음. 이 때 가운데의 pH = pKa인 점을 중심으로 그 점 주변에서는 완만하게 pH가 증가하다가 pH = pKa로부터 +1 혹은 -1정도의 pH 변화폭 바깥을 넘어서게 되면 pH가 엄청나게 급격하게 변화하게 됨.
따라서 pH = pKa인 점으로부터 +1, -1의 범위가 buffering capacity가 있는 지점이라 생각할 수 있음. 따라서 결과적으로 pKa의 값에 따라서 그 buffer의 buffering capacity가 달라지고, 그 결과 buffer의 활용범위가 달라지게 됨.
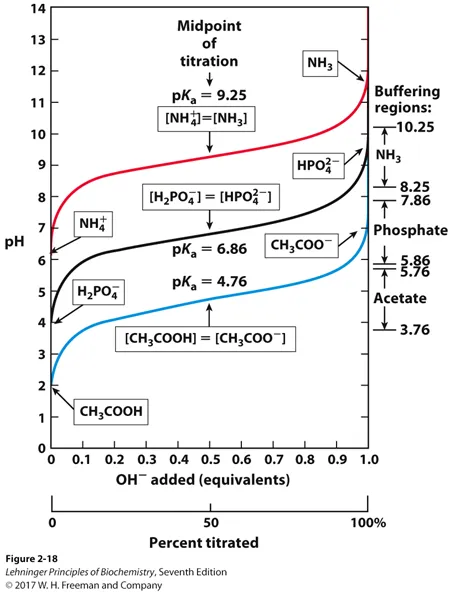
위 그림에는 3가지 다른 pKa 값을 가지는 buffer의 buffering capacity가 나타나 있음. 예를 들어 pH를 한 4.5 근처 범위에서 유지하고자 하는 경우, acetate를 buffer로 사용하는 것이 적당할 것임.

위 그림에는 다양한 물질들의 pKa 범위가 나타나 있으므로 참고할 것.
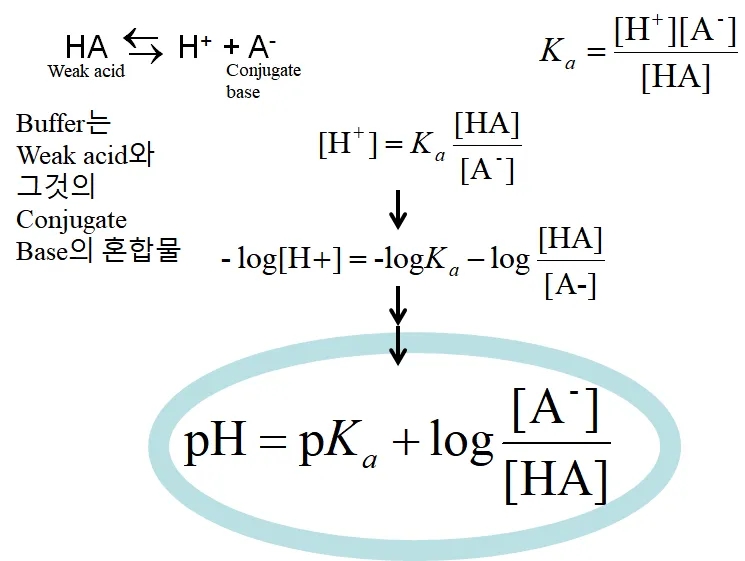
한편, 앞서 위 그림의 가운데에 나와있는 식을 이미 유도한 바 있음. 그런데 이 식에서 log 앞의 -를 log 안으로 집어넣어서 위 그림 아래와 같은 식을 만들게 되면, 이 식이 바로 그 유명한 Henderson-Hasselbalch equation(헨더슨 하셀바흐 방정식)임.

위 그림은 실제로 acetic acid와 acetate가 mix된 채로 구성된 buffer의 외부에서 H+(아래)가 유입된 경우, 그리고 OH-(위)가 유입된 경우에 어떤 식으로 buffer system이 작동하는지를 나타내주고 있음. 보면 H+가 들어올 경우 Ac-가 이 H+를 받아서 HAc로 변하게 되면서, 일종의 H+ 흡수가 일어나게 됨. 한편 OH-가 들어올 경우, 이 OH-는 HAc로부터 H+를 공급받아 H2O가 되어 배출되게 됨. 결과적으로, 충분히 많은 양의 acetic acid와 acetate가 있는 한 외부로부터 들어오는 산, 염기에 의해 buffer 내의 pH가 급격하게 변하는 것이 방지될 수 있음.
buffer system은 biological system에서 매우 중요함. 한 예로 enzyme-catalyzed reaction의 경우에도 buffer가 상당히 중요하게 작용하는데, enzyme의 active site에 있는 amino acid의 경우 특정 pH 하에서만 딱 적절한 charge를 가지고 그 결과 enzyme이 딱 맞는 charge distribution을 가지게 되어 catalysis를 수행할 수 있음.
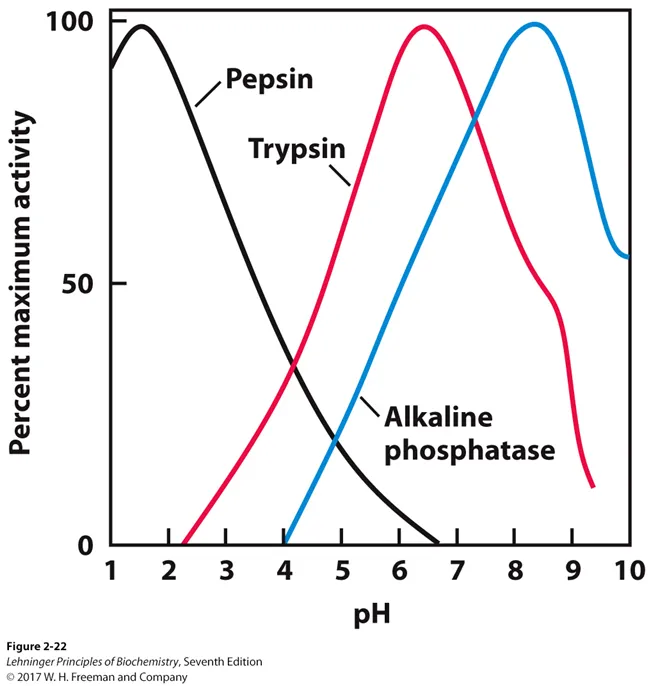
이와 관련된 그림이 위와 같음. 보면 pepsin, trypsin, alkaline phosphatase 등의 enzyme들은 저마다 다른 pH 범위에서 maximum activity를 보임.
그 밖에 polar molecule의 표면에 분포하는 분자들의 경우 charge를 띄고 있으므로, 이들이 제대로 물에 수화되기 위해서는 hydrogen bond donor, acceptor로의 역할을 잘 할 수 있는 charge가 되어야 함. 이를 위해서도 buffer가 중요함.
다음으로 우리 몸의 혈액에서는 CO2 gas와 HCO3-간의 equilibrium이 상당히 중요한데, 이 또한 buffer system임.
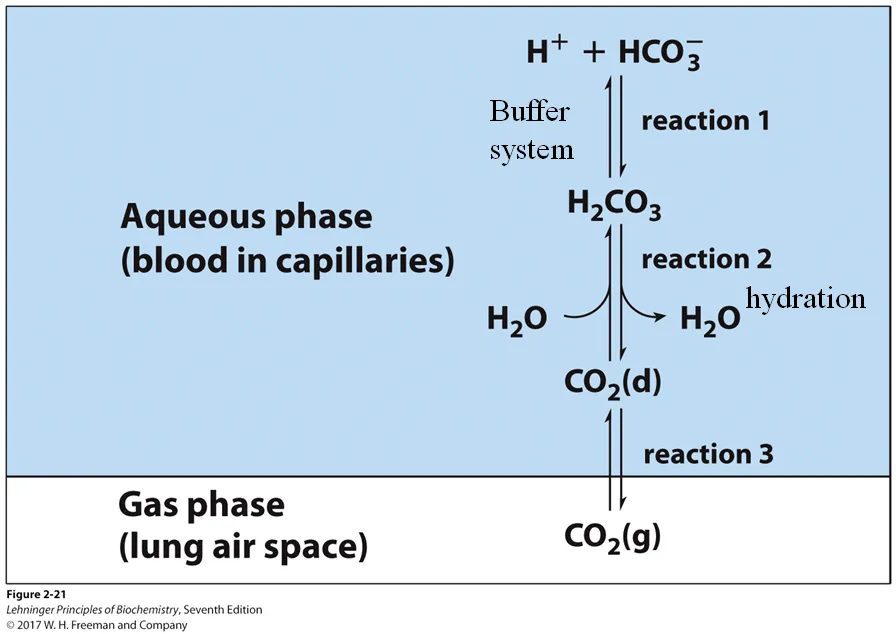
위 그림과 같이 우선 lung을 통해 gas 형태로 유입된 CO2(g)는 blood로 들어와 dissolved되고(CO2(d)) 이후 이 녀석에 물이 첨가되는 hydration 반응이 일어나면서 H2CO3가 형성됨. 그런데 이 녀석은 약산이므로 일부가 HCO3-로 물 내에서 dissolve되게 됨. 이 때 혈액 내에서 결국 약산인 H2CO3와 이의 conjugate base인 HCO3-가 함께 공존하고 있으므로, 이는 buffering system이 되는 것임. 이 buffer system 덕에 우리 혈액 내에서의 pH가 비교적 일정하게 잘 유지될 수 있음.
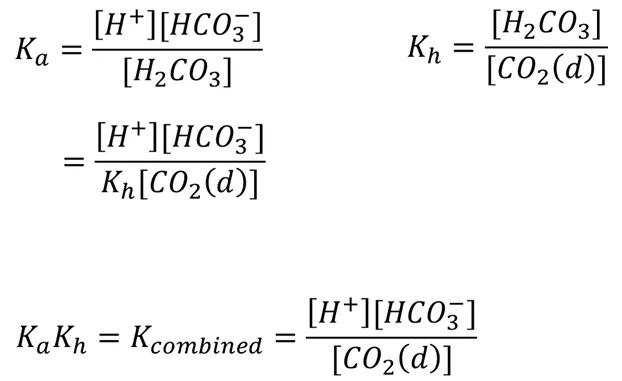
참고로 H2CO3와 HCO3-간의 평형 반응에서의 평형상수 Ka는 위 그림 왼쪽 위와 같이 표현됨. 그런데 dissolved CO2가 hydration되는 반응도 일종의 평형반응이므로 이 반응의 평형상수 Kh 또한 위 그림 오른쪽 위와 같이 표현 가능함. 이 때 Kh 내부에 [H2CO3]의 항이 있으므로, 적절한 이항을 통해 위 그림 왼쪽 가운데와 같이 Ka를 Kh에 대해 나타낼 수 있음. 이후 이 식을 다시 적절히 변형해 KaKh를 한 변에 모은 후 Kcombined를 정의할 시 위 그림 아래와 같이 Kcombined가 정의됨. 이 Kcombined를 이용할 시 혈내 pH를 계산할 수 있음.
그 밖에, phosphate buffer, bicarbonate buffer, histidine buffer 등은 in vivo 상태에서 상당히 중요하게 작용함. (더 나아가, histidine 등이 모여 만들어진 polypeptide와 같은 macromolecule들의 경우에도 buffer로 작용하는 것이 가능함)
이 외에 cyclic amine의 sulfonic acid가 in vitro상에서(cell culture 등) 많이 쓰이기도 함.
이에 대한 대표적인 예로 HEPES buffer, PIPES buffer, CHES buffer 등이 있음.
다음 포스트부터는 단백질에 대해 알아보도록 하자.
'전공자를 위한 생물학 > 생화학' 카테고리의 다른 글
| [생화학] 2.1 : 아미노산(amino acid) - 2 (0) | 2024.11.04 |
|---|---|
| [생화학] 2.1 : 아미노산(amino acid) - 1 (0) | 2024.11.04 |
| [생화학] 1.5 : 물의 이온화(ionization) - 2 (0) | 2024.11.04 |
| [생화학] 1.5 : 물의 이온화(ionization) - 1 (0) | 2024.11.03 |
| [생화학] 1.4 : 삼투압(osmotic pressure) (0) | 2024.11.03 |