이번 포스트에서는 activator들의 기능에 대해 본격적으로 알아보도록 하자.
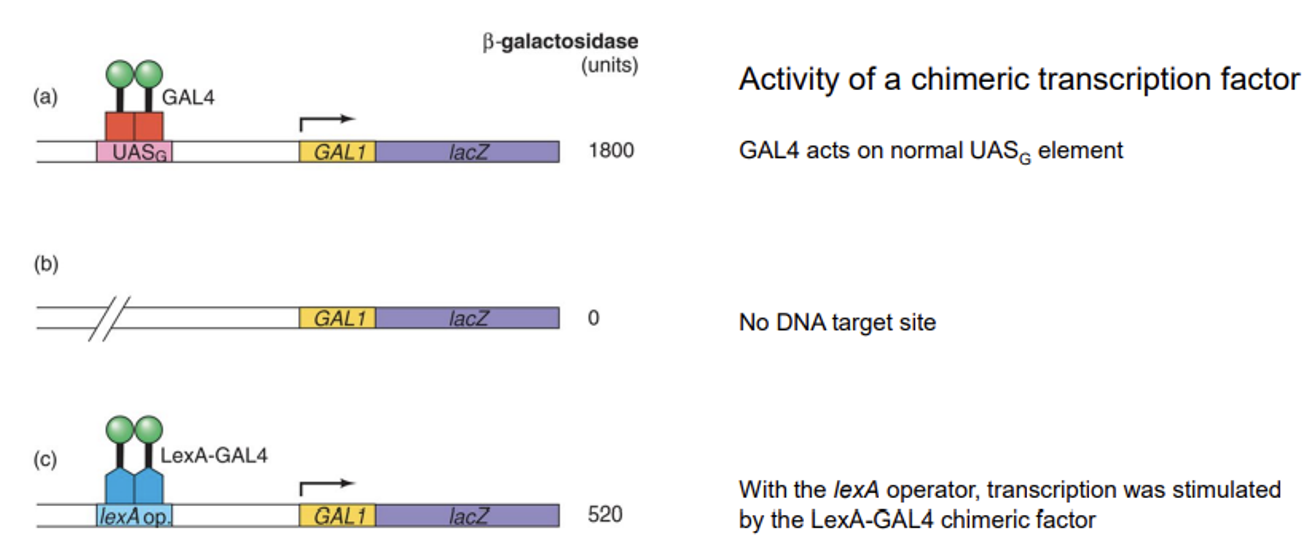
위 그림은 activator를 이루는 DNA-binding domain과 transcription-activating domain이 기능적으로 서로 독립적인지 여부를 확인하기 위한 실험의 결과를 보여주고 있음.
우선 실험 과정에 대해 간단히 알아보자. (a)에서와 같이 GAL4는 특정 DNA element에 붙어 activator의 역할을 수행하고, 그 결과 lacZ gene이 활성화됨. 이 때의 전사 활성도를 beta-galactosidase의 생산 정도로 표현함.
한편 (b)에서와 같이 GAL4가 인지하는 DNA element를 없애준 경우에는 아예 gene 발현이 일어나지 않았음.
이제 본격적으로 검증을 수행하기 위해 (c)에서 나타난 것과 같은 hybrid(fusion) 단백질을 제작함. 이 때 우선 DNA element 자체를 바꿔주었는데, 바뀐 DNA element를 인지할 수 있는 파란색의 DNA-binding domain을 준비함. 한편 GAL4로부터 transcription-activating domain만을 때내서 앞서의 파란색 단백질과 합쳐 hybrid 단백질을 제작함.
그 결과 이 경우에도 gene이 어느정도 activation됨. 이를 통해 activator를 이루는 domain 간에는 어느 정도 기능적인 independence가 존재함을 확인할 수 있음. (물론 (a)와 비교해서 (c)의 전사 활성도가 낮으므로 두 domain이 어느 정도는 의존적인 것이 아닌가 하는 의심을 할 수도 있으나, 위 그림에 나타나지 않은 다른 factor들에 의한 영향일 수도 있기 때문에 이에 대한 여부는 추가 실험을 통해 확인해봐야 할 것임)
eukaryotic activator는 RNA polymerase를 포함한 여러 factor들을 promoter에 recruit시키는 역할을 수행함. 이 때 어떤 방식으로 recruit시키는지와 관련해 2가지 가설이 존재함.

위 그림에 그 두 가지 가설이 나타나 있음. 우선 (a)의 경우 activator가 stepwise로 하나하나 transcription factor들을 build-up하고, 그 결과 complex가 생성된다는 가설임. 다음으로 (b)의 경우 activator가 (우선 TBP를 TATA box에 recruit한 다음) 이미 assemble되어있는 holoenzyme을 TBP로 recruit시킨다는 가설임. 결과적으로 이 가설들은 둘 다 어느정도 맞다는 결론이 내려짐. 지금부터 이와 관련된 실험 결과들에 대해 살펴보자.
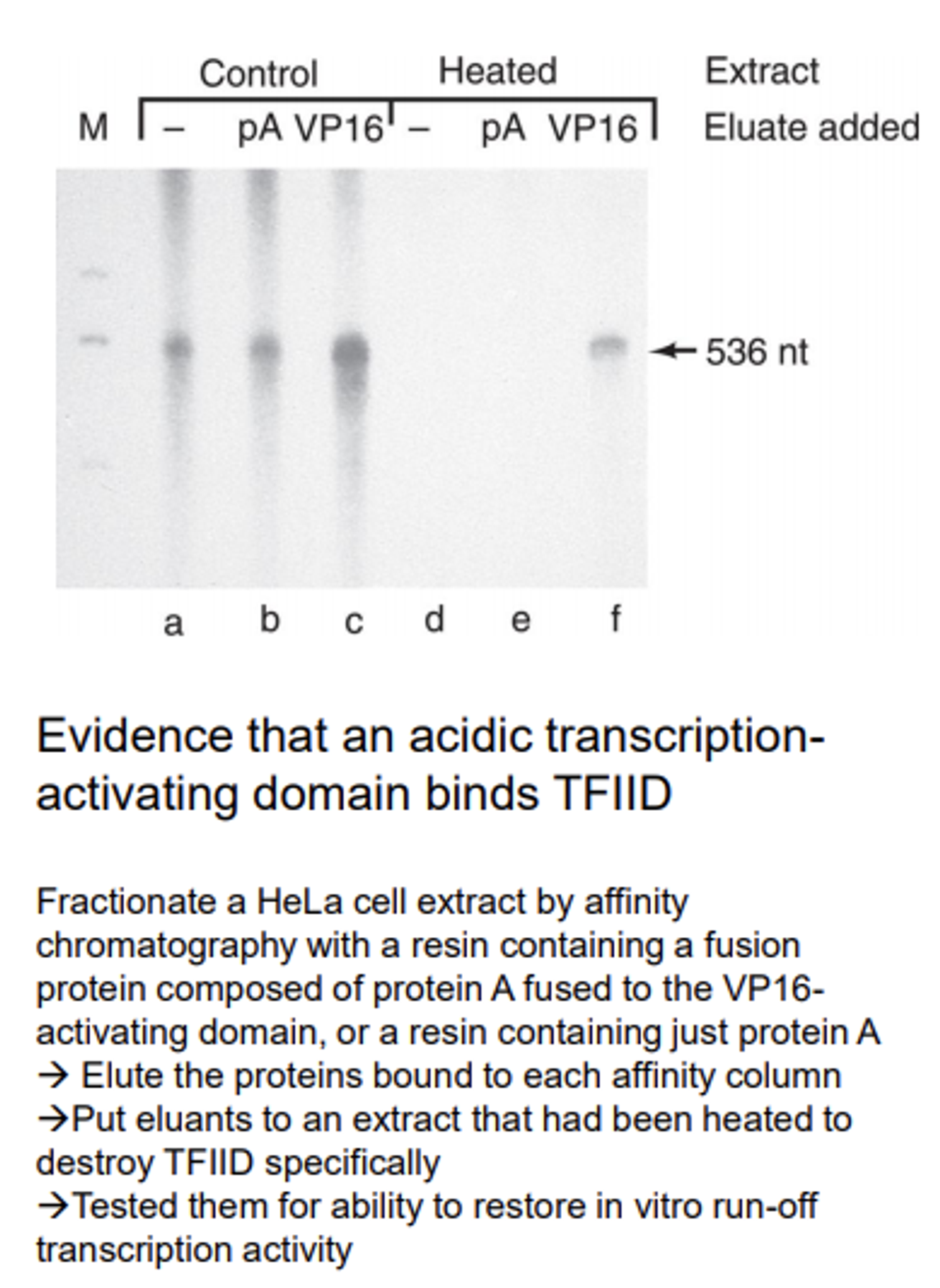
위 그림에 나타나 있는 실험 결과는 activator의 TFIID recruit 활성을 확인한 것임.
우선 위 gel 결과상에 loading된 sample들을 어떻게 만들었는지에 대해서부터 설명할 필요가 있음. 이 때 VP16은 activator 중에서도 trancription-activating domain이고, pA(protein A)는 IgG와 매우 강하게 상호작용하는 녀석임. 이 때 VP16과 pA를 합친 hybrid 단백질을 제작함.
이 단백질과 함께 여러 transcription factor들을 넣어준 후 affinity chromatography를 수행함. (이 때 resin은 IgG를 포함하고 있어서 hybrid 단백질을 포획할 수 있도록 제작되었음) 결과적으로 분획된 hybrid 단백질을 취한 후 이 녀석에 같이 붙어서 온(즉, VP16과 상호작용하면서 마치 co-IP되는 것처럼 딸려온) 단백질들에 대해 조사를 수행하였음.
그 결과 같이 딸려온 녀석이 general transcription factor의 일종인 TFIID라는 것을 알게 됨. 이후 이렇게 recruit된 TFIID가 정말 전사를 activation시키는 역할을 수행하는지 여부를 확인하기 위해 수행한 실험의 결과가 위 그림에 나타나 있음.
우선 gel 전기영동 결과 중 왼쪽은 contol 상황에서의 (cell에서부터 유래된 전사 system에서의) 전사 정도를, 오른쪽은 heat을 가해줬을 때의 전사 정도를 나타내주고 있음. (구체적으로는 run-off transcription activity를 살펴봄. 관련 내용은 아래 포스트 링크 참고)
[분자생물학] 5.5 : nothern blot(노던 블랏), S1 mapping, primer extension, run-off transcription
이번 포스트에서는 전사체(transcript, RNA)를 분석할 때 사용 가능한 각종 분석 방법들에 대해 알아보자. nothern blot (노던 블랏) 우선 nothern blot에 대해 알아보자. 이 방식은 서던 블롯과 매우 유사하
unicellular.tistory.com
이 때 heat을 가해주게 되면 특이적으로 TFIID만을 inactivation할 수 있는 효과가 있음. 그렇게 되었을 때 당연히 contol에 비해 거의 0수준의 전사가 일어남이 확인됨. 그런데 이와 함께 VP16과 결합해 recruit된 단백질을 다시금 넣어줘 봤더니(heated-VP16) 어느 정도 전사 능력이 회복됨.
이를 통해 activator의 transcription-activating domain이 TFIID를 recruit시키고, 그 결과 전사가 촉진된다는 결론을 얻을 수 있었음.
이런 실험 결과를 얻은 이후, 앞서 언급한 것처럼 실제로 activator가 어떤 식으로 transcription factor들을 recruit하는지에 대해 사람들이 더 관심을 가지기 시작함. 이와 관련된 실험 하나를 살펴보자.

(a)부터 살펴보자. 우선 이 실험에는 GAL4라는 activator가 사용됨. 원래는 아래와 같은 GAL4 activator가 lacZ gene의 앞쪽에 존재하고 있음.

그런데 (a)에서는 일부러 GAL4의 transcription-activating domain(초록색)을 때버린 채 LexA라는 DNA binding motif와 GAL4(58-97)부위(dimerization에 관여)만 남겨둠. 그러면 당연히 transcription-activating domain이 없으므로 전사가 activation되지 않을 것임.
한편 위 그림에 나타난 것처럼 holoenzyme에는 GAL11이라는 녀석이 포함되어 있음. 이 때 GAL11은 그 당시 기능이 잘 알려져 있지 않았고, 특히 holoenzyme 생성에는 큰 역할을 하지 않는 것으로 알고 있었음. (기능적으로 의미 X) 그런데 이 녀석이 (b)에서 나타난 것과 같이 mutation을 통해 GAL11P로 변하게 되면, GAL11P는 뜬금없이 GAL4 내의 dimerization과 관련된 부분(회색 부분)과 interaction을 하게 됨.
이 성질을 이용해 GAL11P가 포함된 holoenzyme을 넣어주고 gene expression 정도를 본 것이 (b)임. 보면 이 경우 전사가 잘 일어남. 결국 transcription-activating domain 없이, non-physiological한 GAL11P와 dimerization motif간의 결합만 일어났는데도 전사가 촉진되었으므로, 결과적으로 activator가 holoenzyme 전체를 (어떤 방식으로든) recuit하기만 하면 전사가 촉진된다는 것을 의미함.
이는 (c)를 봐도 알 수 있는데, (c)에서는 아예 LexA와 GAL11을 fusion시킨 후 전사 발현 정도를 보았고, 이 때도 전사가 activation 됨을 확인함. 즉, 이 실험을 통해서는 activator가 holoenzyme 전체를 recruit시켜 전사를 촉진시킨다는 결론을 내릴 수 있음.
그런데, 또 이와 약간은 상반되는 실험결과도 존재함.
만약 모든 activator가 다 holoenzyme 전체를 불러온다면 holoenzyme을 이루고 있는 RNA polymerase subunit, general transcription factor, mediator 등의 개수비는 일정해야 할 것임. (물론 이 때 개수비는 결합비율을 고려한 개수비임) 이 개수비가 정말 일정한지를 확인하기 위해 아래와 같은 실험을 수행함.

위 실험에서는 TAP-tag라는 것을 사용하였는데, 각각의 holoenzyme subunit에 이 TAP-tag를 달아둠. 이 TAP-tag는 protein A에 달라붙으며, 이번에는 이 protein A에 결합 가능한 녀석이 peroxidase임.
이후 peroxidase의 substrate를 처리해줄 시 enzymatic activity를 관찰할 수 있으며, 결과적으로 이를 이용해 비교적 정확하게 단백질의 양을 정량하는 것이 가능함. 이 방법을 이용해서 holoenzyme subunit의 개수를 정량한 결과가 아래와 같음.

실제 실험결과를 보면 개수비가 전혀 일정하지 않음을 확인 가능함.
이 결과는 activator가 holoenzyme 형태를 통째로 가지고 오는 것이 아님을 암시하는데, 앞서 실험에서는 holoenzyme을 통째로 가져오는듯한 결과가 나왔으므로 매우 혼란스러울 수 있음. 이는 아마도 어떤 activator에 의해서는 promoter에 holoenzyme이 통째로 recruit되고, 또 다른 activator에 의해서는 promoter에 stepwise로 recruit되는 일이 발생한다는 것을 암시한다고 볼 수 있음. (즉, 일부 subunit은 몇몇군데서 선택적으로 쓰이고, 일부 subunit은 모든 곳에서 쓰인다는 것을 알 수 있음)
다음 포스트에서는 activator들 간의 상호작용에 대해 알아보도록 하자.
'전공자를 위한 생물학 > 분자생물학' 카테고리의 다른 글
| [분자생물학] 12.5 : transcription factory, complex enhancers, etc (0) | 2023.12.17 |
|---|---|
| [분자생물학] 12.4 : activator들간의 상호작용 (0) | 2023.12.17 |
| [분자생물학] 12.2 : DNA-binding motif의 구조 - 2 (0) | 2023.12.17 |
| [분자생물학] 12.2 : DNA-binding motif의 구조 - 1 (0) | 2023.12.17 |
| [분자생물학] 12.1 : 진핵생물이 가지는 activator들의 분류 (0) | 2023.12.17 |