AAV 벡터는 시중에서 주문할 수도 있지만, 직접 실험실에서 생산할 수 있는 시스템도 있어요.
기본적인 분자생물학 실험과 조직 배양 경험이 있다면, 표준적인 도구만으로도 고품질의 AAV를 생산할 수 있어요. 이번 글에서는 가장 많이 쓰이는 방법인 “helper-free 트리플 플라스미드 트랜스펙션 시스템”을 중심으로 설명할게요.
helper-free 시스템이란?
AAV는 자체적으로 복제할 수 없는 바이러스라서, 보통 helper 바이러스가 필요해요.
원래는 아데노바이러스나 단순포진바이러스(herpes virus)가 이 역할을 했는데, 이 방법은 번거롭고 위험했죠. 그래서 요즘은 helper 바이러스 없이, 플라스미드만으로 helper 기능을 대신하는 helper-free 시스템이 많이 쓰여요.
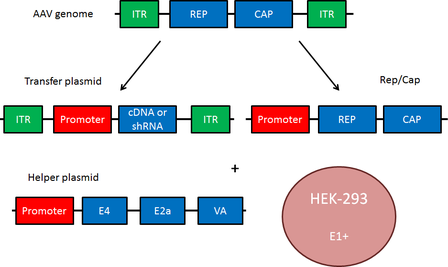
이 시스템은 세 가지 플라스미드를 함께 트랜스펙션해서 AAV를 생산해요:
전달 플라스미드 (transfer plasmid)
유전자가 들어 있는 주인공
RepCap 플라스미드
바이러스 복제 및 캡시드 형성
helper 플라스미드 (pHelper)
아데노바이러스 유래 유전자(E2A, E4, VA RNA)를 공급
이렇게 세 가지를 HEK293T 세포에 트랜스펙션하면, 세포 내에서 rAAV 입자가 조립되고, 배양액 또는 세포 안에 바이러스가 생성돼요.
트랜스펙션 준비와 팁
트랜스펙션에 앞서 HEK293T 세포는 70~80% confluent 정도로 준비하는 게 좋아요. 사용하시는 트랜스펙션 시약(예: PEI, Lipofectamine 등)에 따라 반응이 다를 수 있기 때문에, 미리 소규모로 조건 최적화를 해보는 게 좋아요.
트랜스펙션 후 12~18시간 뒤, 배지를 한 번 갈아주면 독성 물질 제거에 도움이 돼요. 이 과정은 필수는 아니지만, 세포 건강을 유지하고 AAV 생산량을 높이는 데 도움이 되죠.
AAV 수확 – 바이러스는 어디에 있을까요?

AAV는 serotype에 따라 세포 밖(배양액)으로 나오는 경우도 있고, 세포 안에 머무는 경우도 있어요. 예를 들어 AAV2는 세포 안에 많이 남고, AAV9는 비교적 배양액에 많이 분비돼요.
바이러스를 수확할 땐 보통 트랜스펙션 후 2~5일 뒤에 배양액을 수거하고, 세포는 trypsin 처리 없이 스크래핑(scraping)으로 모아요. 어떤 성분에서 더 많이 나오는지는 serotype에 따라 다르니, 실험 목적에 따라 수확 방식을 선택하면 돼요.
빠르게 실험을 진행하고 싶을 땐, 정제 없이 crude lysate나 unpurified supernatant만으로도 실험이 가능한 경우도 있어요. 특히 in vitro 실험에서는 그렇게 많이 하죠. 다만 in vivo 실험이나 민감한 세포는 정제를 꼭 거치는 게 좋아요.
이렇게 해서 AAV를 생산하는 기본 구조를 정리해봤어요. 핵심은 세 가지 플라스미드를 준비해서 HEK293T에 트랜스펙션하고, 일정 시간이 지난 뒤 바이러스를 수확하는 것이죠.
helper-free 시스템 덕분에, 요즘은 AAV를 보다 안전하고 간편하게 만들 수 있어요.
다음 편에서는 이렇게 만들어진 AAV를 어떻게 정제하고, 농축하고, 타이테이션하는지 소개해드릴게요. PEG 처리, iodixanol 그라디언트, 그리고 qPCR 역가 측정까지 다뤄볼 예정이에요.
'전공자를 위한 생물학 > 대학원생을 위한 필수 생물학 개념들' 카테고리의 다른 글
| [AAV] 5편 : AAV의 활용 – 실험실과 임상에서 다재다능한 유전자 전달 도구 (0) | 2025.04.10 |
|---|---|
| [AAV] 4편 : AAV 정제와 타이트레이션 – 깨끗하고 정확하게 준비하는 법 (0) | 2025.04.10 |
| [AAV] 2편 : AAV 플라스미드의 핵심 구성 – RepCap과 전달 플라스미드 (0) | 2025.04.10 |
| [AAV] 1편 : AAV 바이러스란 무엇일까? (0) | 2025.04.10 |
| [렌티바이러스] 3편 : 실험실과 임상에서의 렌티바이러스 벡터 활용 사례와 응용 전략 (0) | 2025.04.10 |