우선 F1에 대해서부터 더 자세히 알아보자. 이 녀석은 3개의 αβ dimer가 모여 형성된 hexamer 형태이며, 각각의 dimer들은 서로 다른 3개의 conformation을 가지고 있음.
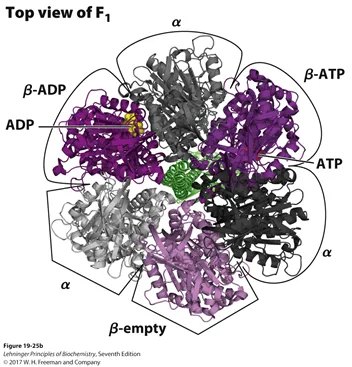
위 그림에 F1의 구조가 나타나 있음. 이 때 각각의 dimer들은 open(empty), loose(ADP, Pi와 붙어있는 상태), tight(ATP formation 후 ATP와 tight하게 결합) 상태 중 하나를 각각 가지게 됨. 이 state들은 F0의 회전에 따른 상대적인 위치 변화에 따라서 변화하게 되며, state의 변화와 함께 ATP가 합성되어 release되게 됨.

위 그림에도 나타나 있는 것처럼 특별히 β subunit에 ADP와 인산기, 혹은 ATP가 결합할 수 있음. 이 때 β subunit의 dissociation constant Kd를 살펴보면 ADP와의 Kd는 10^(-5)M 정도인 반면 ATP와의 Kd는 10^(-12)M 정도임. 이 말인즉슨 β subunit과 ATP 간의 affinity가 상당히 세다는 것임.

그렇기에 위 그림 오른쪽에 나타나 있는 것처럼 강한 binding affinity를 바탕으로 상당히 낮은 energy barrier만 넘으면 ATP의 합성이 일어날 수 있게 됨. 그러나 여기에도 문제가 있는데, β subunit과 ATP가 너무나 강하게 결합하고 있다 보니 ATP가 β subunit으로부터 release되는 step이 상당히 일어나기 어려워질 수 있음.
ATP synthase는 이런 문제를 해결하기 위해 아래와 같은 rotation cycle을 돌게 됨.
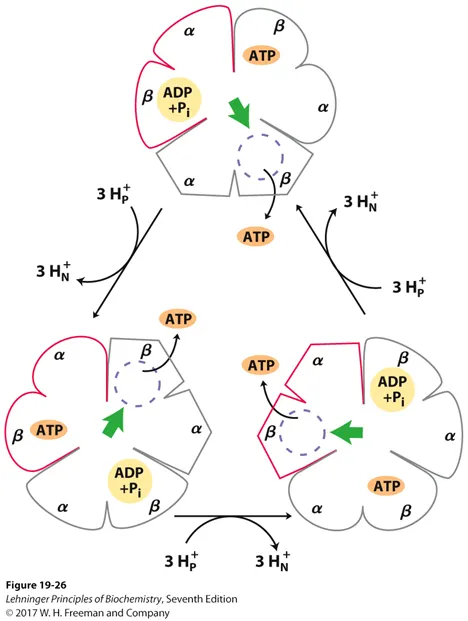
이 과정을 cycle 형태로 나타내 보여주고 있는 것이 위 그림임. (이러한 model을 binding-change model이라 함) 붉게 표시된 부분의 변화에 주목해서 이 model에 대해 하나하나 살펴보자. 우선 맨 위쪽에서의 붉은 부분은 loose state로 이 때는 특별히 β subunit에 ADP와 Pi가 결합해 있는 형태임. 그러다가 3개 가량의 수소이온이 matrix로 들어오며 120도만큼 F1의 상대적 position이 변화하게 되면 위 그림 왼쪽 아래와 같이 tight state가 됨. 이렇게 될 시 β subunit과 ATP간의 binding affinity가 엄청나게 좋아지는 쪽으로 conformation change가 일어나게 되고, 이러한 구조 변화에 의해서 ADP+Pi→ATP의 반응이 거의 자발적으로 일어나게 됨. (결합에너지가 너무 높아 ATP 상태가 워낙 안정하다보니 이런 일이 가능해진 것)
그 결과 β subunit에 tight하게 붙은 ATP가 얻어지게 됨. 이후 3개 가량의 수소이온이 matrix로 더 들어오며 붉은색 부분이 open state로 바뀌게 됨. 이럴 시 β subunit의 ATP에 대한 binding affinity가 거의 없어지게 되면서 ATP가 외부로 release되게 됨. 이후 3개 가량의 수소이온이 matrix로 더 들어오면 비로소 처음 상태로 다시 돌아가게 됨. (이런 cycle이 3개의 dimer에 대해서 동시에 돌아가게 됨)
참고로 위 그림상에서 초록색 화살표는 γ의 orientation을 의미하며 이 orientation이 어디를 향하고 있는지에 따라서 그 위치가 어떤 state가 될지가 결정되는 것임.
다음 포스트에서 이어서 살펴보자.
'전공자를 위한 생물학 > 생화학' 카테고리의 다른 글
| [생화학] 18.3 : 산화적 인산화를 통한 ATP 합성 - 4 (0) | 2025.03.31 |
|---|---|
| [생화학] 18.3 : 산화적 인산화를 통한 ATP 합성 - 3 (0) | 2025.03.31 |
| [생화학] 18.3 : 산화적 인산화를 통한 ATP 합성 - 1 (0) | 2025.03.31 |
| [생화학] 18.2 : 산화적 인산화 각론 - 2 (0) | 2025.03.31 |
| [생화학] 18.2 : 산화적 인산화 각론 - 1 (0) | 2025.03.31 |