이번 포스트에서는 단백질의 1차구조(primary structure)에 대해 알아보자.
primary structure의 형성에 있어서 가장 중요한 것은 바로 peptide bond임. peptide bond는 protein에서 가장 많은 공유결합으로 backbone 형성에 상당히 중요함. (물론 이 밖에 disulfide bond를 비롯한 다른 종류의 공유결합들도 있기는 함)
peptide bond에 의해서 resonance structure가 만들어질 수 있음.

이를 밝혀낸 사람들이 위 그림에 나타나 있는 Linus Pauling과 Robert Corey인데, 이들은 X-ray crystallography를 이용해 resonance structure가 있음을 파악함.

실제로 resonance는 위와 같이 일어남. 이 때 C-N의 결합이 일반적인 C-N 단일결합의 길이에 비해 더 짧다는 관찰을 통해서 아무래도 single bond보다는 더 strong한 결합이 C-N 사이에 형성되어 있을 것이라는 생각을 하게 되었고, 이로부터 resonance를 예상하게 된 것임.
그러다 보니 peptide bond의 경우 일반적인 C=O, N-H에 비해서 덜 reactive하고 stable한 성향이 있음. (즉, 쉽게 말해 peptide bond는 ester보다 덜 reactive함)
결과적으로 peptide bond는 꽤나 rigid하고 거의 planar함. (O-C-N-H가결과적으로 peptide bond는 꽤나 rigid하고 거의 planar함. (O-C-N-H가 거의 한 평면에 위치)
그리고, electron이 왔다갔다 하는 과정에서 위 그림 가운데처럼 dipole moment를 형성할 수 있음. 따라서 이들은 쉽게 H-bond를 이룰 수 있음.
peptide bond의 rotation은 불가능한데, 이는 resonance structure에 의해 peptide bond가 double bond character를 어느정도 가지기 때문임. 그 대신 peptide bond 주변에 있는 α carbon 부위는 rotation될 수 있음. 이 때 형성되는 angle 두 개가 바로 φ(phi)와 ψ(psi)임.

위 그림와 같이 φ angle은 amide nitrogen bond, 즉 N과 Cα가 이루는 각을 의미함. 한편 ψ angle은 carbonyl carbon bond, 즉 Cα와 C가 이루는 각을 의미함. 이 두 종류의 각에 따라서 protein의 구조가 상당히 많이 영향을 받게 됨. 참고로 이들 두 종류의 각을 통칭해 dihedral angle이라고 부름.
만약 fully extended conformation을 가지는 polypeptide를 생각한다면, 이 경우 φ, ψ는 모두 180도일 것임.

조금 더 구체적으로, (b) 그림에 나온 것과 같이 φ의 경우 C, N, Cα평면과 N, Cα, C 평면이 이루는 각을, ψ의 경우 N, Cα, C 평면과 Cα, C, N 평면이 이루는 각을 의미함.
위 그림 (c), (d)에는 φ angle에 대한 또 다른 측정법이 나타나 있음. 보면 N, Cα, C를 세로 일직선상에 놓은 뒤 나머지 하나의 N이 수직한 직선에 대해 몇도인지를 재게 되면 이 것이 φ가 됨.
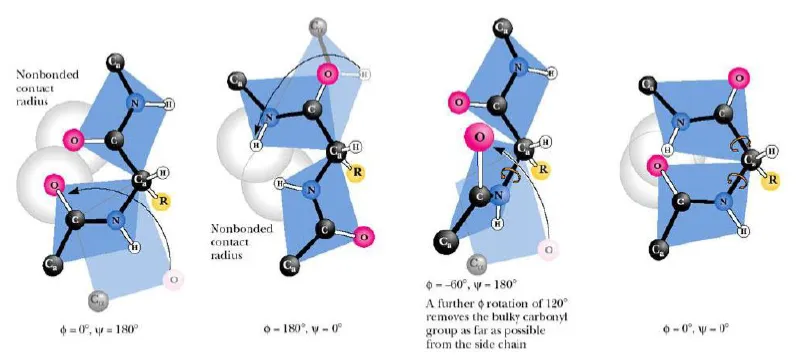
사실, 모든 φ, ψ값이 다 가능한 것은 아닌데, 위 그림 맨 왼쪽, 맨 오른쪽에 나타난 것처럼 특정 각 조합에서는 steric hindrance(steric crowding)가 너무 많이 발생해서 구조가 안정하게 유지되는 것이 불가능함.
반면 어떤 각 조합의 경우 H-bonding interaction을 더 쉽게 하게끔 하는 조합도 존재함.
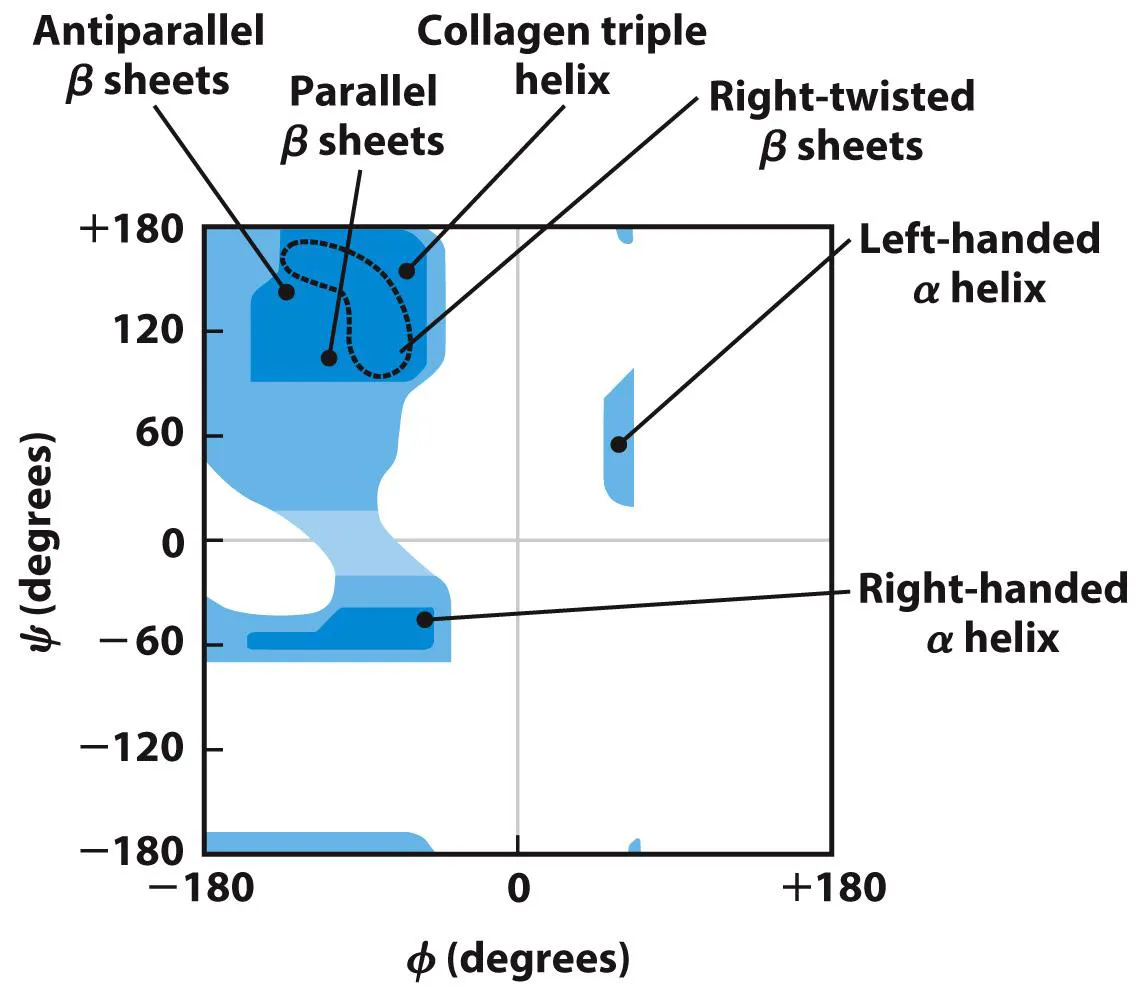
위 그림에는 실제로 단백질 내에서 관찰될 수 있는 φ, ψ angle의 조합을 나타내는 Ramachandran Plot(라마찬드란 플랏)이 나타나 있음. 보면 생각보다 제한적이며, 특정 secondary structure의 경우 더 국소적인 angle값만 가진다는 것을 알 수 있음.
그런데, glycine의 경우 사실 side chain이 H여서 사실상 효과가 없기 때문에 매우 free함. 그 결과 glycine의 경우 위 Ramachandran plot 상에서 어느 angle 조합도 다 가질 수 있음. 따라서 이 녀석까지 plot에 포함하게 되면 너무 복잡해지므로 그냥 빼고 표현한 것임.
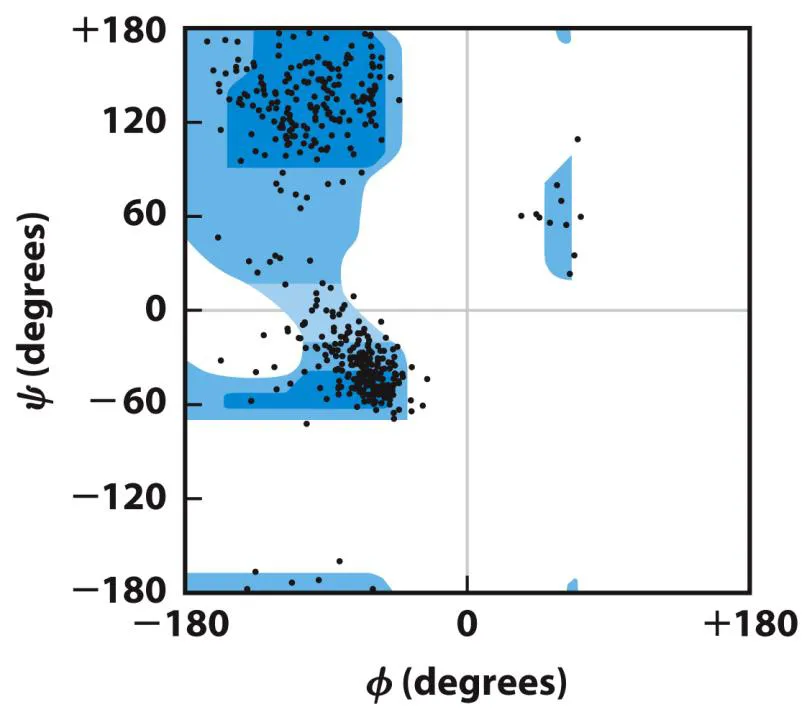
위 그림은 실제로 (glycine을 제외하고) protein의 angle 값을 plotting해본 것임. 보면 실제로 굉장히 잘 matching되는 것을 알 수 있음.
다음 포스트에서는 단백질의 2차구조(secondary structure)에 대해 알아보자.
'전공자를 위한 생물학 > 생화학' 카테고리의 다른 글
| [생화학] 3.3 : 단백질의 2차구조(secondary structure) - β sheet (0) | 2024.11.05 |
|---|---|
| [생화학] 3.3 : 단백질의 2차구조(secondary structure) - α helix (0) | 2024.11.05 |
| [생화학] 3.1 : 단백질의 접힘(folding) (0) | 2024.11.04 |
| [생화학] 2.8 : 단백질 시퀀싱(protein sequencing) (0) | 2024.11.04 |
| [생화학] 2.7 : 단백질의 농도, 단백질의 활성 (0) | 2024.11.04 |