이번 포스트부터는 단백질의 2차구조(secondary structure)에 대해 알아보자.
그 중에서도 이번 포스트에서는 α helix(α 헬릭스)에 대해 알아보자.
대표적인 secondary structure에는 α helix와 β sheet가 있음. α helix는 4, 5개 거리의 인접한 amino acid가 서로 H-bond를 통해 연결되어 생성된 구조를 말함. 한편 β sheet는 β strand가 여럿 모여 있는 구조로, α helix보다는 보다 더 먼 amino acid들끼리의 상호작용에 의해 형성됨.
이 밖에, disordered된 form으로 irregular한 arrangement로 polypeptide chain들이 연결되어 있는 것을 random coil이라 부름. 이 random coil의 경우 Ramachandran Plot 상에서 하나의 region에 한정해서 나타나지 않음.

위 표에는 각종 secondary structure들이 typical하게 가지는, 혹은 이 구조들을 optimal하게 형성하게끔 해주는 φ, ψ angle 값들이 나타나 있으므로 참고할 것.

α helix는 위와 같이 n번째 amino acid와 n+4번째 amino acid들의 backbone 간에 H-bonding이 일어나서 형성되는 구조임. (이 때 backbone의 N-H - - - O=C 사이에 H bonding이 일어남)

α helix는 위와 같이 right-handed helix일 수도 있고 left-handed helix일 수도 있음. 이 중 보통 right-handed helix가 더 typical하게 관찰되며, 대략 한 바퀴 돌 때마다 5.4 옹스트롬씩 전진하는 정도의 구조임.
참고로 α helix는 H-bonding이 가장 효율적으로 일어났을 때 자연스레 얻어지는 구조라 할 수 있음.
흥미롭게도, peptide bond는 helical axis에 거의 parallel하게 배향되어 있고, side chain은 helical axis에 대략적으로 perpendicular하게 배향되어 있음.

위 그림의 (b)를 보면 실제로 side chain이 양 가쪽으로 쭉 뻗어나와 있고, 가운데 부분은 아주 좁은 편이며 비어있다는 것을 알 수 있음. (그런데 가운데 부분의 inner diameter는 4~5 옹스트롬 정도여서 무언가가 안쪽에 fit하기에는 size가 너무 작음. 참고로 outer diameter는 10~12옹스트롬 정도임. 이 경우 물론 side chain에 따라 다르기는 하겠지만 보통 dsDNA의 major groove에 잘 fit할 수 있는 size임)
한편 (c)를 보면 α helix 구조가 상당히 tight하게 packing되어 있다는 것을 알 수 있음. 그리고 바깥쪽에 R기가 뻗어나와 있으므로 나중에 R chain들끼리도 쉽게 interaction하는 것이 가능함. 일반적으로 예를 들어 세포 막에 interaction하는 부위가 왼쪽이다 하면 실제로는 (c)의 왼쪽 side 부분에 hydrophobic한 amino acid들이 다 align되게 됨. 이 때 (d)와 같이 대략 1과 8, 2와 9 정도의 위치관계에 있는 녀석들이 한 바퀴를 거쳐 같은 side에 위치하게 됨.
이런 점을 잘 고려할 시 protein을 design해서 특정 기능을 잘하게 만들수도 있을 것임.
α helix의 구성에 방해가 되는 amino acid도 있고, 오히려 안정성을 더 증가시켜주는 amino acid도 있음. 일단 small hydrophobic residue인 Ala, Leu 등의 경우 R기 끼리 서로 interaction을 쉽게 할 수 있어 매우 stable하므로 strong한 helix former임.
한편 Pro, Gly는 helix breaker임. 일단 proline의 경우 ring structure를 가지고 있는데 이 ring structure가 H-bond를 형성할 때 방해가 될 수 있음. 그리고 Gly의 경우 R기가 H여서 너무나 flexible하고 dynamic하기에 R기 간 interaction이 없어서 helix breaker로 작용할 수 있는 것임.
그래서 실제로 α helix 중간에 Pro, Gly가 들어가면 helix가 뚝 끊어지거나, 혹은 ㄱ자, ㄴ자로 굽어지는 등의 일이 일어날 수 있음.
+) 만약 Arg, Lys와 같은 서로 + charge를 띄는 amino acid들이 근방에 있다면 helix는 불안정해질 것이고, lys, glu와 같이 +, - charge를 띄는 녀석이 있다면 이 경우 salt bridge가 형성되며 helix가 더 안정화될 것임.
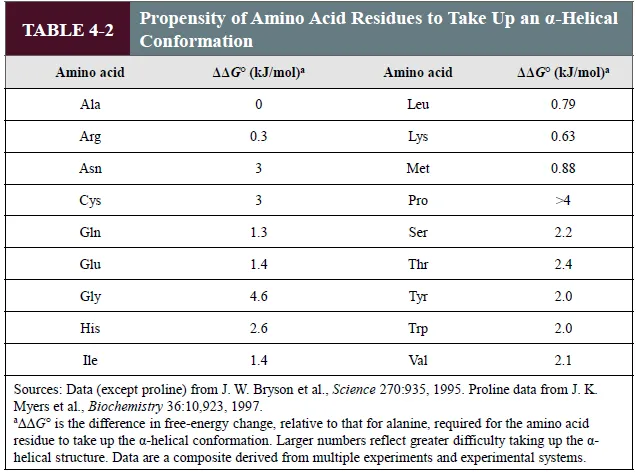
위 표는 α helix 중간에 특정 amino acid들을 넣어봤을 때 helix의 안정성이 어떻게 변하는지를 실험해본 결과를 담고 있음. 보면 ala를 넣었을 때 가장 안정한 것을 알 수 있음.
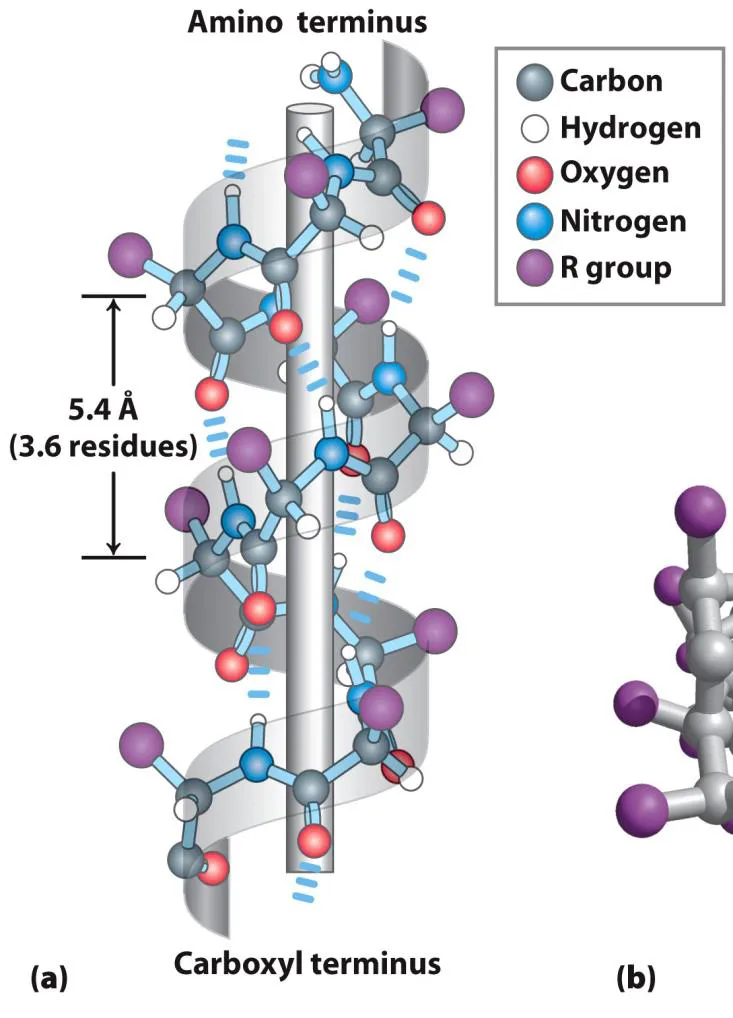
한편, 이 그림을 다시 보면 신기하게도 C-O(carbonyl)는 다 아래쪽을 향해있고, N-H(amide)는 다 위쪽을 향해 있는 것을 알 수 있음. 이 때문에 아래와 같이 helix dipole이 형성될 수 있음.
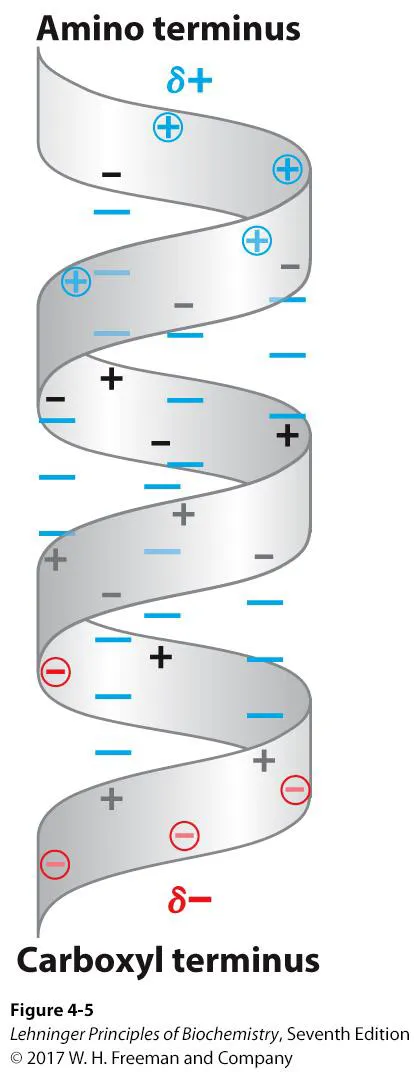
보면 결국 위 그림 상에 나타난 것과 같이 helix의 양쪽 끝 부분의 amino acid는 일반적으로 H-bond를 형성하고 있지 않으므로 부분 극성을 띈 채 남아있게 될 것이고, 이 것이 dipole로 작용할 수 있게 됨. 따라서 이 dipole의 성질 그대로 작용하는 경우도 꽤나 많이 존재함. 그 밖에, 어떤 경우에는 dipole이 naked 상태로 존재하는 것이 energy 측면에서는 그다지 안정하지 않으므로 +, - charge를 띄는 다른 compound와 상호작용해서 더 안정화된 채로 존재하기도 함.
다음 포스트에서는 β sheet에 대해 알아보도록 하자.
'전공자를 위한 생물학 > 생화학' 카테고리의 다른 글
| [생화학] 3.4 : 단백질의 3차구조(tertiary structure) - fibrous protein (0) | 2024.11.05 |
|---|---|
| [생화학] 3.3 : 단백질의 2차구조(secondary structure) - β sheet (0) | 2024.11.05 |
| [생화학] 3.2 : 단백질의 1차구조(primary structure) (0) | 2024.11.04 |
| [생화학] 3.1 : 단백질의 접힘(folding) (0) | 2024.11.04 |
| [생화학] 2.8 : 단백질 시퀀싱(protein sequencing) (0) | 2024.11.04 |