이전 포스트에 이어서 살펴보자.
glutamine synthetase는 nitrogen metabolism에 있어서 primary한 regulatory point임.

이 때 실제로 위와 같은 regulation이 일어남. 보면 크게 8개의 inhibitor들이 alloestric하게 glutamine synthetase를 inhibition하게 됨. 일반적으로 bacterial glutamine synthetase의 경우 12개의 identical한 subunit을 가지는데, 각각의 subunit들은 independent한 active site를 가지고 있을 뿐만 아니라 allosteric position 또한 각자 다 가지고 있음. 따라서 각각의 subunit들은 8개의 allosteric effector들에 의해 accumulative하게 inhibition되고 있는 것임.
그리고 더 흥미로운 것은, 각각의 inhibitior들은 하나씩 붙었을 때는 아주 partial한 inhibition만 일어나지만 multiple inhibitor들이 additive하게 작용할 시 (더 나아가 8개의 inhibitor들이 다 작용할 시) enzyme이 totally shut down됨. 이 때 AMP, Tryptophan, Carbamoyl phosphate, glucosamine 6-phosphate, histidine, CTP, glycine, alanine 등의 inhibitor들은 위 그림상에 나타나 있는 것처럼 glutamine synthetase에 의해 생성되는 후속 product들에 해당함.
한편, 이런 allosteric inhibition 기작 외에, adenylation에 의한 glutamine synthetase의 regulation 기작도 존재함.

위 그림에 이와 관련된 regulation mechanism이 나타나 있음. 실제로 위 그림 (a)에는 glutamine synthetase의 active site, 그 중에서도 Tyr residue에 Adenylylation이 일어나 있는 구조가 묘사되어 있음.
위 그림 아래에 나타나 있는 것처럼 glutamine synthetase는 adenylylation되면 inactive한 form이 되고, deadenylylation되면 active한 form이 됨. 그렇다면 이들의 adenylyation status는 어떤 녀석에 의해 조절될까.
일단 glutamine synthetase의 substrate가 많음을 indicate해줄 수 있는 α-ketoglutarate, 그리고 energy가 풍족함을 indicate해주는 ATP는 UT(uridylyltransferase)의 활성도를 증가시키고, 그 결과 PII라고 하는 단백질에 UMP를 첨가시켜버림.
이후 uridylylation된 PII와 AT(adenylyltransferase)가 결합할 시 이 complex는 glutamine synthetase를 deadenylylation시키고 그 결과 glutamine synthetase가 activation되어서 glutamate가 glutamine으로 전환됨. (ammonia가 glutamine 내에 incorporation됨) 한편 glutamine synthetase에 대한 product가 많음을 indicate하는 glutamine이 많아질 경우 이 녀석은 UT를 inhibition시키고 그 결과 PII의 deuridylylation이 유발되게 됨.
이어서 UMP가 붙지 않은 PII가 AT와 결합하게 될 시, 이번에는 이 complex에 의해 glutamine synthetase의 adenylylation이 유발되고 그 결과 glutamine synthetase가 불황성화되게 됨.
(참고로 glutamine synthetase에 일어나는 adenylylation은 효소 활성 전체를 block한다보다는, inhibitor에 대한 enzyme의 sensitivity를 높이는 역할을 함)
그리고 사실 UMP가 incorporate된 상태의 PII는 위 그림상에서 나타나 있는 역할 이외에, glutamine synthetase를 encoding하고 있는 gene의 transcription 정도도 증가시켜주기도 함.
이제 우리가 익히 알고 있는 각종 amino acid들의 biosynthesis 과정에 대해 조금 더 자세히 알아보자.
일단 이런 biosynthesis 과정에서는 transamination과 rearrangement가 매우 중요함. 이 때 중요한 cofactor가 PLP(pyridoxal phosphate)임. 이 PLP는 vitamin B6의 active form이며, 아래 그림과 같이 생김.

한편, transamination을 시켜주는 효소는 aminotransferase임. 위 그림상에 나타나 있는 PLP는 aldehyde group을 가지고 있어서 aminotransferase의 Lys residue와 Schiff base를 형성한 채 존재할 수 있음.

위 그림에는 glutamine amidotransferase의 구조와 작동 mechanism이 나타나 있음. (앞서 glutamine에 ammonia가 incorporation되는 것에 대해 살펴봤으므로, 이제는 이렇게 incorporation되어있는 NH3가 어떻게 다른 분자로 transfer되는지에 대해 살펴보는 것임) 보면 enzyme 내에 크게 glutamine-binding domain과 NH3-acceptor domain의 2개 domain이 존재하고, 이 2개 domain 사이에 NH3가 전달될 수 있는 channel이 존재하고 있음. (이런 system으로 구성되어 있기에 NH3를 정확히 전달할 수 있는 것임)
보면 glutamine-binding domain 내에 있는 Cys residue가 nucleophile로 작용해서 Gln 내의 amide bond를 cleavage시켜줌. 그 결과 위 그림 아래와 같이 glutamyl-enzyme intermediate가 생기며, NH3는 channel로 빠져나가 NH3-acceptor domain 내에 존재하는 substrate에 가서 결합하게 됨.
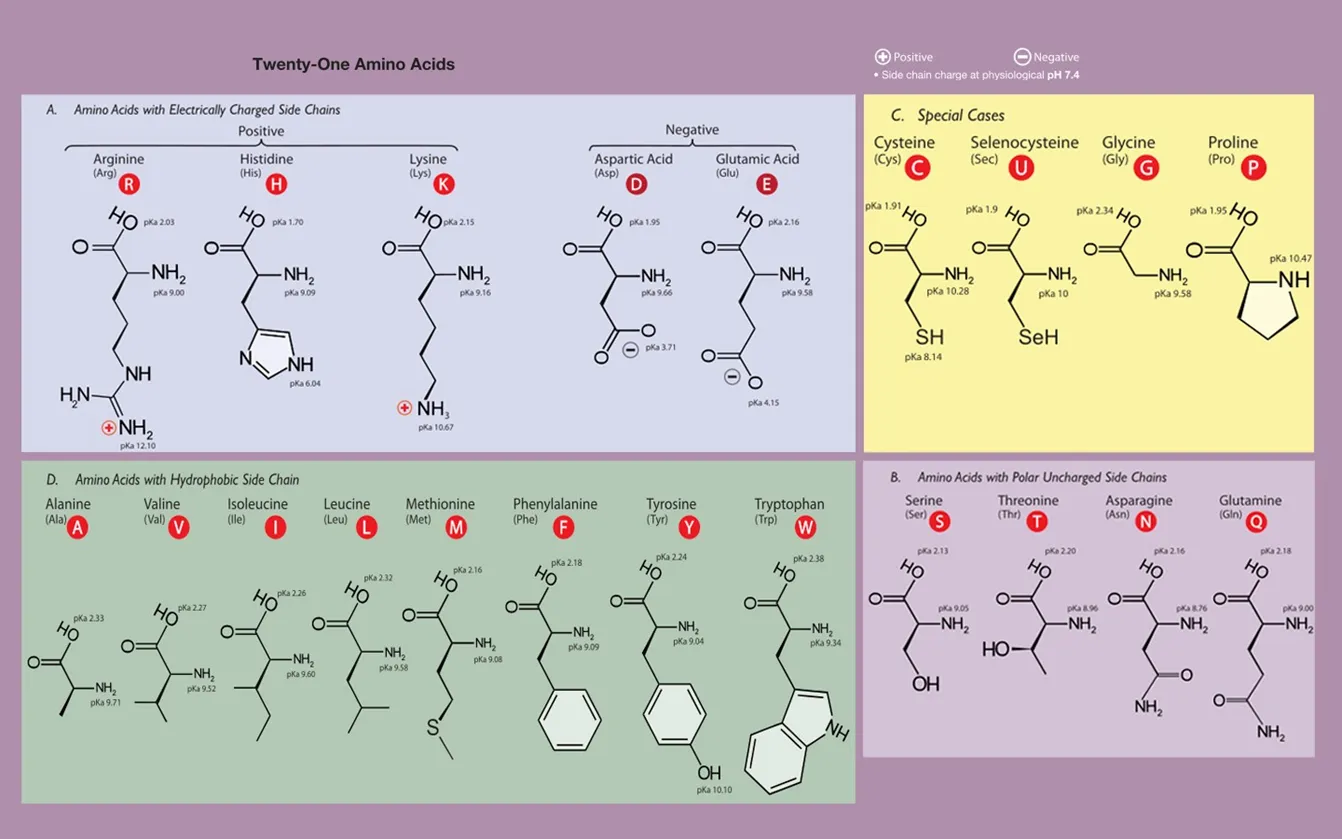
위 그림에는 20여종의 amino acid들이 나타나 있음. 이제 이들의 합성 과정 각각에 대해 다음 포스트에서 조금 더 알아보자.
'전공자를 위한 생물학 > 생화학' 카테고리의 다른 글
| [생화학] 21.1 : 아미노산의 생합성 - 6 (0) | 2025.04.09 |
|---|---|
| [생화학] 21.1 : 아미노산의 생합성 - 5 (0) | 2025.04.08 |
| [생화학] 21.1 : 아미노산의 생합성 - 3 (0) | 2025.04.07 |
| [생화학] 21.1 : 아미노산의 생합성 - 2 (0) | 2025.04.07 |
| [생화학] 21.1 : 아미노산의 생합성 - 1 (0) | 2025.04.07 |