이번 포스트에서는 생물학적 관점에서 대표적으로 관찰되는 산화환원반응에 대해 알아보자.
일반적으로 우리가 섭취하는 food는 상당히 reduce(환원)된 compound인데, 이들이 metabolism을 통해 분해되는 과정에서 전자가 방출되며 oxidation(산화)이 일어나며, 이렇게 방출된 전자는 사람과 같은 생물의 경우 최종적으로 O2로 전달됨. 이런 과정을 거쳐 ATP가 생산되는 것임.
일반적으로 oxidation(산화)과 reduction(환원)은 pair로 일어나며, 그 밖에 생물학적 oxidation 반응은 주로 dehydrogenation이라는 것 정도를 기억해두면 좋을 것임.
한편 electronegativity 관점에서 O>N>S>C>H의 순서를 가지므로 결국 O, C가 있을 시 O가 전자를 다 빼앗고, H, C가 있을 시 C가 전자를 다 빼앗는 식임. 한편 C, C가 있을 시 C 2개가 전자를 한개씩 나눠가지는 식임.

이와 관련된 그림이 위와 같음. 이 때 나타나 있는 숫자는, 앞서 살펴봤던 electronegativity를 고려해서 C가 가질 수 있는 전자의 갯수를 의미함. 이 수가 크면 클수록 C가 더 reduce된 form이라고 생각할 수 있을 것임. 이런 관점에서 봤을 때 CO2가 가장 oxidize된 형태임.
상식적인 측면으로, 산소를 얻거나, 전자를 잃거나, 수소를 잃는 반응이 모두 oxidation이라는 것 정도는 기억해 둘 필요가 있음.
그렇다면 electron donor에서 electron acceptor로의 전자 전달은 어떻게 이루어지는 것일까. 크게 4가지 방식이 있음.

우선 위와 같이 전자의 형태로 직접 전달되는 경우가 있음.
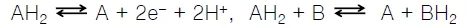
그 밖에 위와 같이 hydrogen atom의 형태로 전달되는 경우도 있음.
이 외에 hydride ion, 즉 수소가 전자를 두 개 포함하고 있는 형태로 전달되는 경우도 있는데, 대표적으로 NAD-linked dehydrogenase에서 이런 형태의 전달이 발견됨.

마지막으로 위와 같이 oxygen의 전달이 수반된 방식도 있음.

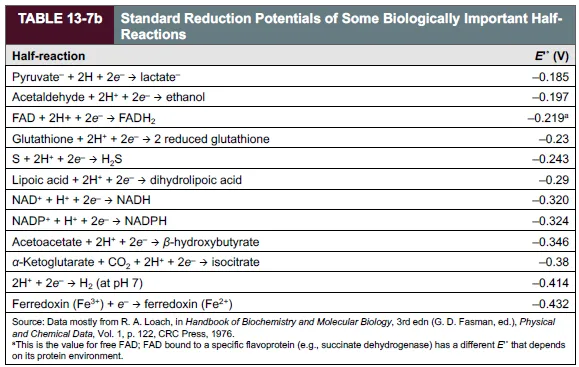
위 표들은 각종 환원 반응이 잘 일어나는 정도, 다시 말해 환원이 잘 되는 정도인 standard reduction potential(표준 환원위)을 나타내주고 있음. 이 때 2개의 수소이온과 2개의 전자가 만나서 H2가 되는 반응의 standard condition 하에서의 reduction potential을 0으로 둔 상태에서 나머지 reduction potential의 상대적인 값을 계산하게 됨. 구체적으로는, standard hydrogen cell로부터 전자를 받으면 E◦가 positive해질 것이고, standard hydrogen cell에 전자를 주면 E◦가 negative해질 것임.
다음 포스트에서 이어서 살펴보자.
'전공자를 위한 생물학 > 생화학' 카테고리의 다른 글
| [생화학] 13.1 : 당 대사 개론 (0) | 2025.03.25 |
|---|---|
| [생화학] 12.4 : 산화-환원 반응 - 2 (0) | 2025.03.25 |
| [생화학] 12.3 : ATP - 3 (0) | 2025.03.25 |
| [생화학] 12.3 : ATP - 2 (0) | 2025.03.01 |
| [생화학] 12.3 : ATP - 1 (0) | 2025.02.28 |