이번 포스트에서는 아미노산의 이온화(ionization)에 대해 알아보자.

carboxylic acid는 acidic pKa를 가지고(7보다 작은 값) low pH에서 위 그림 위쪽과 같이 deprotonate됨. 한편 amino group은 basic pKa를 가지고, high pH에서 위 그림 아래쪽과 같이 protonate됨.

위 그림의 왼쪽은 acidic한 조건에서 methyl group에 carboxyl group이 붙어있는 acetic acid와 glycine을 비교한 결과를 보여주고 있음. 이 비교는 사실상 methyl group에 carboxyl group만 붙어있을 때에 비해 amino group이 추가적으로 붙어있을 때 어떤 효과가 있는지를 보는 비교라 보면 됨.
결과적으로 acetic acid의 pKa는 4.8인 반면 glycine의 pKa는 2.34임. 이런 차이가 나타나는 이유는 다음과 같음. 일단 acetic acid의 경우 C에 H가 3개 붙어있어 이들은 전혀 기능을 하지 못함. 한편 glycine의 경우 H 하나 대신 amino group이 붙어있음. 이 amino group은 acidic한 상태에서 NH3+의 형태로 protonate되어있을 것임. 이 amino group은 carboxyl group에 있는 전자를 일정 수준 잡아당기는 속성을 가지게 됨. 결과적으로 carboxyl group의 proton이 더 쉽게 release되게 될 것임. 그 결과 pKa가 더 작아지게 됨.
다음으로 위 그림의 오른쪽은 basic한 조건에서 methyl group에 amino gorup이 붙어있는 methylamine과 glycine을 비교한 결과를 보여주고 있음.
결과적으로 methylamine의 pKa는 10.6, glycine의 pKa는 9.6으로 나타남. 이는 basic한 condition 하에서 COO-의 형태로 존재하는 carboxyl group에 의해서 amino group으로부터 전자가 끌려가게 되고, 그 결과 amino group으로부터 proton이 더 쉽게 release되게 된 결과에 해당함.
한편 low pH에서는 일반적으로 amino acid가 positively charged form, 즉 cation으로 존재하고 high pH에서는 일반적으로 amino acid가 negatively charged form, 즉 anion으로 존재함.

한편, cation으로 존재할 때와 anion으로 존재할 때 R기가 아닌 나머지 amino group, carboxyl group 중 어느 것이 charged되는지의 여부가 다 다름. 결과적으로 위 그림과 같이 carboxyl group이 -1가 이온으로 변화하는 과정에서의 평형상수 pK1(carboxyl group 관점에서의 pKa)과 amino group이 charge를 가지지 않는 form으로 변하는 과정에서의 평형상수 pK2(amino group 관점에서의 pKa)가 위 graph와 같이 각각 따로 존재하게 될 것임. 그리고 이들 pK1, pK2 각각에서 +1, 혹은 -1의 pH 범위에서는 buffering effect가 유발될 것임. (참고로 위 그림은 특히 R기가 H인 glycine을 보여주고 있음)
그런데, cation과 anion으로 존재할 때 각각의 functional group에 의해 형성되는 pKa값의 중간에 있는 값인 pI 지점에서는 위 그림 맨 위쪽에 나와있는 것처럼 glycine 내부에 + charge도 존재하고 - charge도 존재함. 이와 같은 상태를 Zwitterion(양쪽성이온)이라 부름.
방금 등장한 pI(isoelectric point, 등전점)라는 개념은 매우 중요함. pI는 amino acid의 net charge가 0일 때의 specific pH 값을 의미함. 즉, pI에서는 amino acid의 물에 대한 solubility가 최소화되고, electric field 하에 amino acid를 놔둔다고 해도 migration되지 않음.
이 때 glycine, 혹은 alanine 등처럼 R기가 ionization되지 않는 녀석일 경우에는 단순히 아래와 같이 pK1, pK2의 평균값으로 pI를 계산할 수 있음.

그러나 ionization이 일어나는 R기를 가지고 있는 경우에는 조금 더 많은 사항들을 고려해야 함. 구체적으로는, Zwitterion이 pK1, pK2 중 어디에 더 가까운 쪽에서 생기는지에 대해 생각해 보아야 함.

위 표에 각각의 amino acid에 대한 pI 값이 나타나 있음. 이 중 glutamic acid를 예로 들어 생각해보자. 이 경우 R기 내에 carboxyl group이 존재할 것이고, 이 녀석은 산성 환경에서 - charge를 띌 수 있을 것임. 따라서 zwitterion은 pK1과 가까운 방향에서 생길 것이라는 것을 알 수 있음. 이에 대한 확신이 생겼다면, pI 값은 단순히 (pK1 + pKR)/2의 수식으로 계산 가능함.
한편 다른 예시로 lysine을 생각해보자. 이 경우 lysine의 R기에 amino group이 있으므로 이 R기는 계속 + charge를 띄다가 basic한 환경이 되면 비로소 중성화될 것임. 따라서 zwitterion은 pK2와 가까운 방향에서 생길 것이라는 것을 알 수 있음. 이에 대한 확신이 생겼다면, pI값은 단순히 (pKR + pK2)/2의 수식으로 계산 가능함.
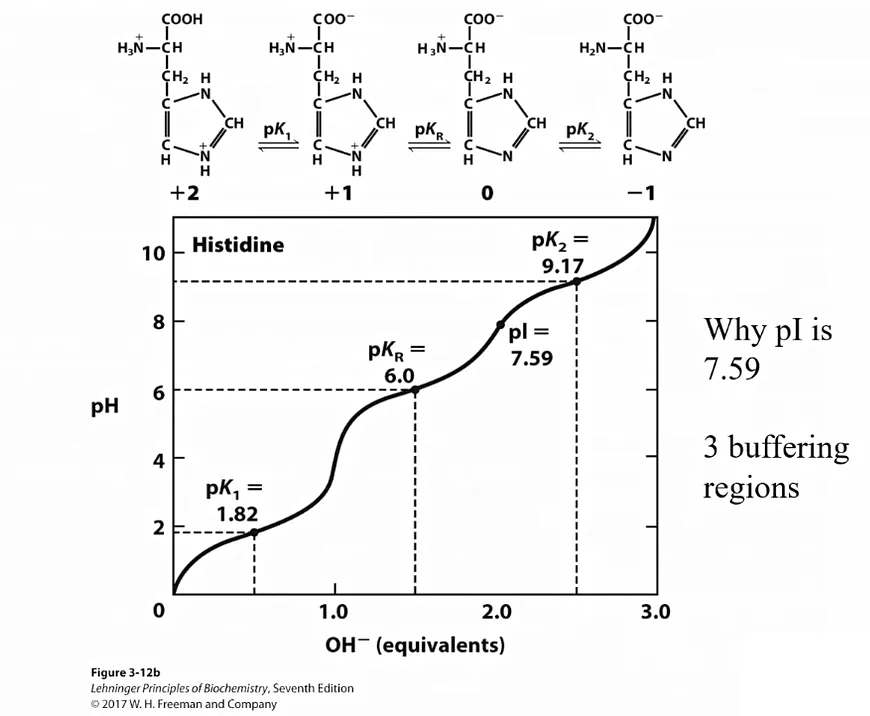
이처럼 R기가 ionization 가능한 amino acid의 경우 결과적으로 위와 같이 3군데의 buffering region이 생길 것임. (pK1, pKR, pK2 근방 +1, -1 범위의 pH range) 한편 위 그림에 나타나 있는 histidine의 경우에도 R기가 + charge를 띄고 있으므로 결과적으로 pI는 (pKR + pK2)/2 의 수식으로 계산 가능하다는 것을 알 수 있음.
다음 포스트부터는 펩타이드(peptide)에 대해 알아보도록 하자.
'전공자를 위한 생물학 > 생화학' 카테고리의 다른 글
| [생화학] 2.3 : 펩타이드(peptide) - 2 (0) | 2024.11.04 |
|---|---|
| [생화학] 2.3 : 펩타이드(peptide) - 1 (0) | 2024.11.04 |
| [생화학] 2.1 : 아미노산(amino acid) - 2 (0) | 2024.11.04 |
| [생화학] 2.1 : 아미노산(amino acid) - 1 (0) | 2024.11.04 |
| [생화학] 1.6 : 버퍼(buffer) (0) | 2024.11.04 |