
앞서 1편에서 앞서 항체의 기본 구조와 기능을 살펴보았는데요. 실험실에서는 흔히 “1차 항체(primary antibody)”와 “2차 항체(secondary antibody)”라는 용어를 접하게 되죠. 처음 듣는 분들은 “항체에 1차, 2차가 있다니 무슨 뜻이지?” 궁금할 거예요. 이번 글에서는 1차/2차 항체의 개념과 그 차이, 그리고 각각을 언제 어떻게 사용하는지 알아볼게요.
1차 항체란?

1차 항체(primary antibody)는 말 그대로 표적이 되는 항원에 직접 결합하는 항체를 뜻해요. 예를 들어 세포 속 특정 단백질 A를 검출하려 할 때, 그 단백질 A에 특이적으로 결합하는 항체가 1차 항체이죠. 연구자들은 보통 쥐(mouse), 토끼(rabbit), 염소(goat) 등의 동물을 이용해 원하는 항원에 대한 1차 항체를 만들어내게 되죠. 구체적으로 항원을 동물에 주사하면 동물의 B 세포들이 항체를 생산하게 되고, 그 결과 1차 항체를 얻어낼 수 있어요.
이렇게 얻은 1차 항체는 크게 두 종류로 나뉠 수 있어요: 단일클론(모노클론) 항체와 다클론(폴리클론) 항체예요. (단클론/다클론 항체에 대해서는 다음 시리즈 글에서 자세히 다룰 예정이니, 여기서는 1차 항체 맥락에서 간단히 짚고 넘어갈게요.)

단클론 항체(monoclonal Ab)
B 세포 한 종류(클론)에서 유래한 항체로, 항원 내 하나의 특정 에피토프만 인식해요. 따라서 매우 높은 특이성을 가지며, 실험 결과의 재현성이 좋아요.
다클론 항체(polyclonal Ab)
여러 B 세포 클론들이 만들어낸 항체 혼합물이라, 같은 항원 내 여러 가지 에피토프들에 결합할 수 있어요. 상대적으로 검출 신호가 강하고 다양한 형태의 항원 변화를 인식할 수 있지만, 배경 신호나 교차반응이 일어날 가능성이 높아요.
연구자는 실험 목적에 따라 단클론 또는 폴리클론 중 적합한 타입의 1차 항체를 선택하게 됩니다. 1차 항체는 주로 표적 단백질의 존재 유무나 위치를 밝혀내기 위해 사용하는데, 예를 들면 세포 내 특정 단백질을 염색하거나(western blot, IF 등) 조직에서 발현을 확인할 때 1차 항체를 먼저 사용해 표적에 달라붙도록 하죠.
2차 항체란?

2차 항체(secondary antibody)는 1차 항체에 결합하기 위해 만들어진 항체예요. 좀 특이하죠? 2차 항체는 항원이 아닌 다른 항체를 인식하도록 개발된 항체랍니다. 일반적으로 2차 항체는 1차 항체의 불변 부위(Fc 영역)에 붙도록 만들어져요. 예를 들어, 1차 항체로 토끼에서 얻은 항체를 썼다면, 그 1차 항체의 Fc 부분에 결합하는 “항-토끼 IgG” 2차 항체를 사용하게 되는 것이죠.
2차 항체의 가장 큰 역할은 표지(label)를 붙여서 1차 항체가 결합한 항원을 간접적으로 검출하는 거예요. 대부분의 1차 항체는 실험에 사용할 때 아무 표지가 없기 때문에, 그 자체로는 눈에 보이지 않거나 신호를 내지 않습니다. 그래서 효소나 형광염료 등이 붙어있는 2차 항체를 이어서 처리해주면, 1차 항체에 달라붙은 2차 항체 덕분에 시각화가 가능해지죠. 이를 통해 연구자는 항원의 존재를 사진으로 찍거나 기계로 신호를 측정할 수 있어요.
예를 들어, 세포 내 단백질 A를 1차 항체로 염색한 다음에, 그 1차 항체를 인식하는 2차 항체에 형광물질을 붙여주면, 형광현미경으로 단백질 A가 어디에 있는지 볼 수 있습니다. 마찬가지로, 2차 항체에 효소(HRP 등)를 붙여두면 웨스턴 블롯에서 표적 단백질 밴드를 화학발광 신호로 검출할 수 있어요.
그렇다면 왜 2차 항체를 쓰는 번거로운 방식을 취할까요? 직접 표지된 1차 항체(예: 형광 직결합 1차 항체)를 쓰면 2차 항체가 필요 없겠지만, 간접법(1차+표지 2차)의 장점은 신호 증폭과 유연성이에요.
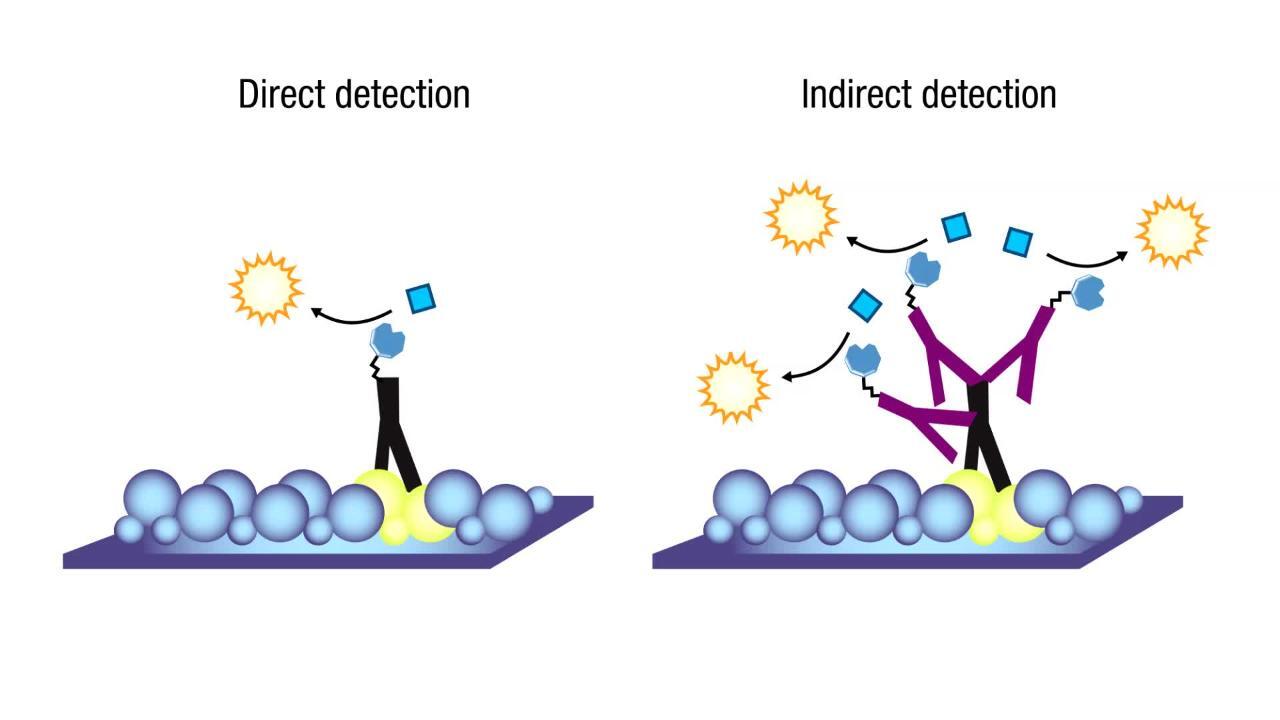
하나의 1차 항체에 여러 개의 2차 항체가 붙을 수 있어서 신호가 증폭되고, 표지된 2차 항체 한 종류만 준비해두면 다양한 1차 항체들과 조합해서 사용할 수 있으니 경제적이에요. 예컨대 토끼에서 만든 1차 항체들에는 공통으로 항-토끼 2차 항체를 쓸 수 있으니까요. 이렇게 함으로써 여러 가지 1차 항체마다 각각 표지를 붙일 필요 없이, 표지된 2차 항체 하나로 여러 실험에 범용할 수 있게 되죠.
1차 항체와 2차 항체의 사용
1차 항체
표적 항원에 첫 번째로 투여되어 직접 결합합니다. 예를 들어 웨스턴 블롯 실험에서는 막에 고정된 단백질에 1차 항체를 먼저 붙여주는 단계가 있어요. 면역염색에서도 세포나 조직에 1차 항체를 먼저 처리하여, 세포 안의 특정 단백질과 결합시키죠.
2차 항체
1차 항체 처리 후, 두 번째 단계로 투여되어 1차 항체에 붙어요. 2차 항체에는 형광 염료, 효소, 금 입자 등 다양한 표지가 연결되어 있어서, 1차 항체가 어디 붙어있는지 눈에 보이게 만들어주는 역할을 해요.
. 2차 항체는 반드시 1차 항체의 “종(species)”에 맞는 것을 선택해야 해요. 이를테면 1차 항체를 쥐에서 얻은 항체로 썼다면 “항-쥐” 2차 항체를, 염소에서 얻었으면 “항-염소” 2차 항체를 써야 한다는 것이죠. 또한 1차 항체의 아이소타입(isotype)도 고려해야 하는데, 대부분의 1차 항체는 IgG라서 2차 항체도 항-IgG이면 되지만, 만약 IgM 1차 항체를 썼다면 항-IgM 2차 항체를 써야 해요.
1차/2차 항체 사용의 예시
예를 들어, 세포 내에 있는 단백질 액틴(actin)을 형광으로 염색하고 싶다고 해볼게요. 먼저 액틴에 특이적인 1차 항체(예: 토끼 유래 항액틴 항체)를 세포에 처리하여 액틴 단백질에 결합시킵니다. 그 다음 형광 색소가 결합된 2차 항체(예: 염소 유래 항-토끼 IgG 항체에 녹색 형광 Alexa Fluor 488 표지)를 처리하면, 1차 항체에 2차 항체가 붙고 녹색형광 신호를 내게 되죠. 최종적으로 형광현미경으로 보면 세포 골격을 이루는 액틴들이 녹색으로 빛나 보이면서, 세포 형태와 액틴의 분포를 시각화할 수 있어요.
이처럼 1차 항체와 2차 항체는 짝을 이루어 실험에 사용되는데, 요약하자면 1차 항체는 표적을 인식하고, 2차 항체는 표적에 붙은 1차 항체를 인식하면서 눈에 보이거나 검출 가능한 신호를 내도록 해주죠.
다음 편에서는 1차 항체 제작 방식에 따른 분류인 단클론 항체와 폴리클론 항체의 차이에 대해 더 깊이 알아볼게요. 이는 항체를 어떻게 만들고 활용하느냐와 직결되는 흥미로운 주제예요.
'생물학 맛보기 > 생물학 이모저모' 카테고리의 다른 글
| [항체] 4편 : 항체의 응용 – Western Blot, 면역형광(IF), 유세포 분석(FACS)에서는 어떻게 쓰일까요? (0) | 2025.03.28 |
|---|---|
| [항체] 3편 : 단일클론 항체 vs 폴리클론 항체 – 어떻게 만들어지고 어떤 차이가 있을까요? (0) | 2025.03.28 |
| [항체] 1편 : 항체란 무엇일까요? 구조와 기능 알아보기 (0) | 2025.03.28 |
| [신약개발] 5편 : FDA 승인, 어떻게 준비하고 통과할 수 있을까? (0) | 2025.03.28 |
| [신약개발] 4편: FDA 승인이란? 신약과 의료기기의 시장 진입을 위한 첫 관문 (0) | 2025.03.28 |