이번 포스트에서는 비공유결합성 상호작용(noncovalent interaction)들과 관련된 내용들에 대해 살펴보자.
noncovalent interaction이란 electron pair를 직접적으로 공유하지는 않으면서 형성되는 분자간의 interaction을 의미함. 대표적인 예들로는 Ionic(Coulombic) interaction, Dipole interaction, van der Waals interaction, Hydrophobic effect가 있으며, 방금 나열한 순서대로 세기가 점점 더 약해짐. (→방향)
ionic interaction은 영구적으로 charged된 species들 간에 일어나는 electrostatic한 interaction임. 이는 ion-ion간에 발생할 수도 있고, ion과 permanent dipole 사이에서도 발생할 수 있음. 이 때의 interaction은 attraction일수도, repulsion일 수도 있음.
Dipole interaction은 charge되지는 않았지만 polar한 molecule들간에 일어나는 electrostatic interaction임. (여기에 hydrogen bond가 포함됨)
van der Waals interaction은 분자의 polarity 여부와 전혀 상관없이 모든 atom들 사이에서 일어날 수 있는 interaction임. 이 때의 interaction 또한 두 상호작용 대상들 간의 거리에 따라서 attractive하게(London dispersion) 작용할 수도 있고 repulsive하게(steric hindrance) 작용할 수도 있음. 참고로 분자간의 attractive force는 polarizability, 즉 분극이 이루어진 정도에 의해 결정됨. 한편 repulsive force는 분자들이 너무 가까이 위치하게 될 시 electron들 사이에서 생기는 반발하는 힘임.
마지막으로 hydrophobic effect은 물 분자와 친하지 않은 분자, 혹은 분자의 일부분들끼리 한 곳에 모이게 되는 effect를 의미함.

이와 관련된 몇 가지 예시를 나타내주고 있는 표가 위와 같으므로 참고할 것.
ionic interaction
우선 ionic interaction에 대해 먼저 알아보고, 이런 ionic interaction이 수화에 의해 어떻게 깨져서 dissolving이 일어나는지에 대해 알아보자.

우선 ionic interaction의 세기 F는 위와 같이 나타낼 수 있음. 이 때 ε은 dielectric constant로, charge를 가진 녀석이 혼자서 고립된 채로 charge를 그대로 계속 유지하려는 정도를 나타내주는 척도임. 따라서 당연히 이러한 성질이 적을수록(고립되지 않고, charge를 공유하며 interaction을 잘 할수록) F값이 커질 것임.
그런데 위 식을 보면 분모에 거리의 제곱이 들어가 있는 것을 알 수 있음. 이 때문에 ion들 간의 거리가 대략 40nm이상으로 멀어지게 되면 ionic interaction의 효과는 거의 없어지게 됨. (즉, 다시 말해 ionic interaction은 거리에 매우 민감함)

한편 위와 같이 ionic interaction으로 서로 연결된 crystal lattice가 물에 들어갈 경우 각각의 ion들이 물분자에 의해 둘러싸여 수화되며 dissolve되게 됨. 이는 entropy의 관점에서 바라볼시 쉽게 이해 가능한데, lattice는 매우 규칙적이므로 entropy가 상당히 낮은 반면 물 분자에 의해 수화되게 되면 entropy가 더 증가하게 됨. 따라서 수화반응은 entropy 관점에서 favorable함. 이에 더해 본 수화반응의 ΔH는 아주 작은 양수이기 때문에 결과적으로 ΔG는 음수가 되어서 열역학적으로 자발적임.
van der Waals interactions (반데르발스힘)
van der Waals interaction은 분자 내의 random한 전자 이동의 결과 순간적으로 분자의 한쪽 부분에 전자가 치우치게 되며 발생하는 아주 순간적인 분극에 의해 일어나는 interaction임. 그렇기에 이 때의 interaction은 어떨 때는 매우 동적일 수 있음. 한편 van der Waals interaction의 세기는 일반적으로 분자의 표면적이 크면 클수록 더 세짐.
앞서 말했듯 van der Waals interaction은 거리에 따라 attractive할수도, repulsive할 수도 있는데, 이 때 분자들 간의 거리가 상대적으로 먼 경우(0.4-0.7nm)에는 attractive한 force가 dominant하다가, 너무 두 분자 사이의 거리가 가까워지게 되면 repulsion force가 더 dominant해지게 됨.
그런데 이 거리 range 안에 깁스 자유에너지가 최소가 되는 distance인 van der Waals contact distance가 존재함. 이 거리에서 일반적으로 가장 안정하므로, 일반적으로 van der Waals interaction을 통해 상호작용하는 분자들 간의 거리는 van der Waals contact distance로 추정할 수 있음.
이러한 추정을 바탕으로 실제로 우리는 biomolecule 전체의 '모양' 그 자체를 예측할 수 있는것임.
van der Waals interaction은 개별적으로는 매우 weak하고, 이 덕분에 쉽게 깨질 수 있으며 reversible함. 또한 이 interaction은 어떠한 biomolecule 내, 혹은 biomolecule 간에서도 일어날 수 있으므로 매우 universal함.
van der Waals interaction은 steric complementarity(즉, 상보성)에도 매우 중요하며, 각종 biological macromolecule들을 stabilize시켜주며, polarizable ligand들이 receptor와 binding 할 때, 이 binding을 촉진해주는 역할을 함.
hydrophobic interaction (소수성 상호작용)
hydrophobic interaction은 nonpolar molecule들이 물 속에서 어떤 분포를 하고, 어떤 상호작용을 하는지를 설명하기 위해 필요한 핵심적인 interaction임. 이러한 interaction은 protein folding, protein-protein association, lipid micelle의 형성, steroid hormone과 receptor간의 결합 등에서 매우 중요함.
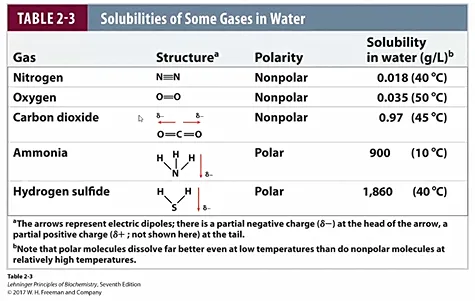
위 표에는 hydrophobic한 물질들과 hydrophilic한 물질들의 예시와, 이들 각각의 물에 대한 solubility의 예가 나타나 있으므로 참고할 것.
그런데 왜 nonpolar한 molecule들은 water에서의 solubility가 낮을까.
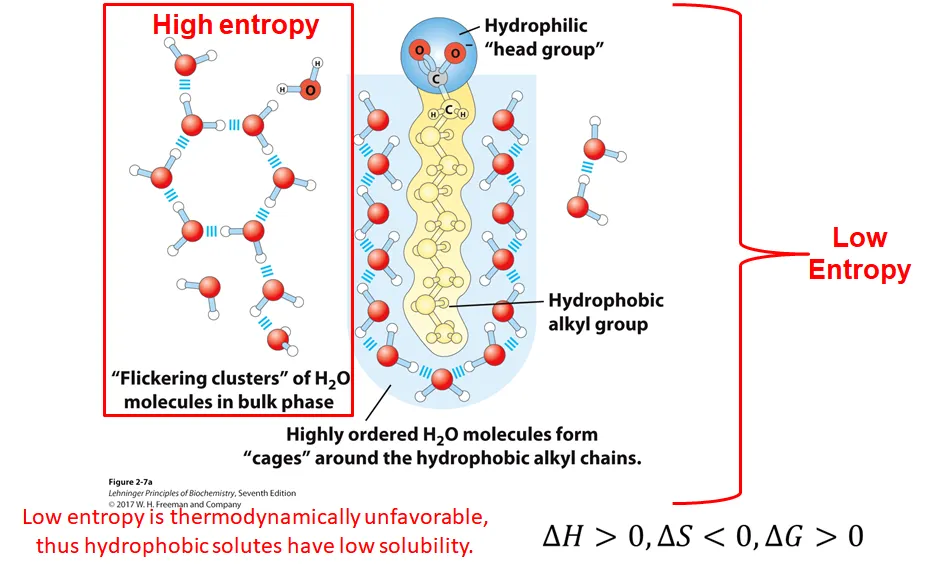
우선 위 그림 왼쪽과 같이 물만 존재하고 있는 경우를 생각해보자. 이 경우 물 분자들이 상대적으로 자유롭게 이동하고 있으므로 그 결과 entropy가 높은 상태임.
한편 위 그림 오른쪽과 같이 물 내부에 fatty acid tail이 존재하고 있는 경우에는, 이 tail을 감싸는 형식으로 물 분자가 일정 layer로 배열되게 됨. 그런데 결국 이 때의 배열은 물 분자의 질서도를 높이게 되고, 그 결과 entropy가 낮아지게 됨. 따라서 nonpolar molecule의 수화 반응에서의 ΔS는 음수임. 한편 이 반응의 ΔH 값은 양수가 되고, 결과적으로 ΔG 값은 양수가 되어서, 이 반응은 열역학적으로 unfavorable함. 이러한 열역학적 설명은 왜 nonpolar molecule의 water solubility가 낮은지를 설명해줌.
다음으로, 양친매성인, 즉 amphipathic한 lipid가 물에 있는 경우를 생각해보자.
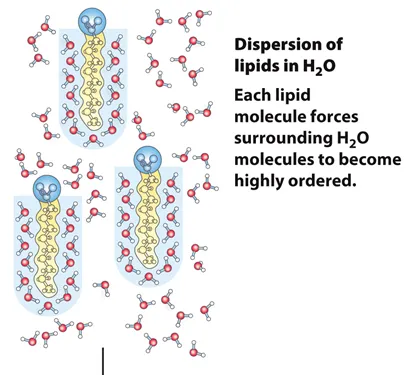
일단 각각의 amphipathic lipid가 따로따로 물에서 존재하고 있는 경우를 나타내준 그림이 위와 같음.
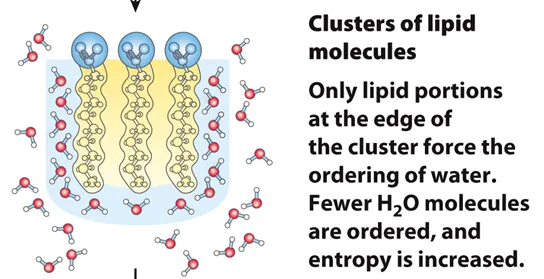
한편 총 3개의 lipid들이 서로 cluster를 이루었을 때의 모습은 위와 같음.
이 둘을 비교해보면, 따로따로 존재하고 있을 때에 비해서 같이 cluster로 뭉쳐서 존재할 때, 주변부에 tail을 따라 정렬되는 물분자(highly ordered water molecule)의 수가 더 적다는 것을 알 수 있음. 결과적으로 lipid가 각자 떨어져 있는 상황에서부터 cluster를 형성하는 변화 과정의 ΔS는 양수임. 결과적으로 이러한 clustering 반응은 열역학적으로 favorable함.
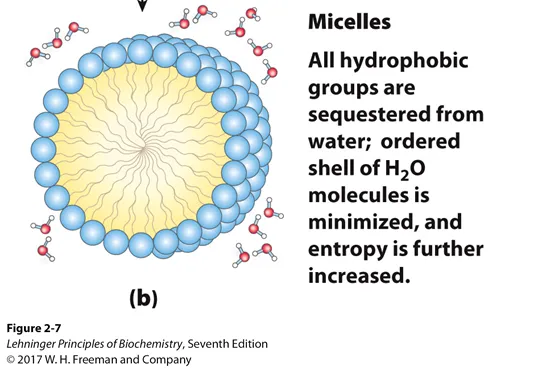
이 논리를 그대로 확장해나가다 보면, 수많은 양친매성 lipid들이 존재하는 경우 위와 같이 micelle을 형성하게 되는 반응이 열역학적으로 favorable하다는 것을 쉽게 이해할 수 있을 것임.
(참고로, 굳이 양친매성 분자가 아니라고 하더라도 hydrophobic effect에 의해 모이는 것이 가능함.
enzyme과 substrate간의 interaction에서도 이 hydrophobic effect가 매우 중요하게 작용함.
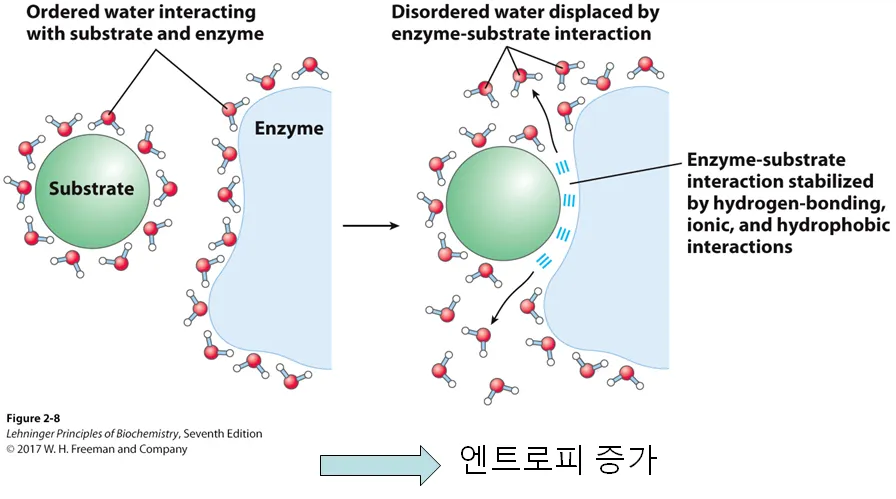
보면 왼쪽과 같이 substrate와 enzyme이 각각 존재하고 있는 경우 water molecule이 이들 각각을 감싸서 상대적으로 entropy가 낮음. 그런데 위 그림 오른쪽과 같이 substrate와 enzyme이 결합하게 될 시 이들 사이에 원래 결합되어 있었던 물분자가 sequester되면서 결과적으로 질서정연한 물분자의 수가 줄어들게 되고, 결국 이러한 substrate-enzyme 상호작용 반응에서의 ΔS도 양수가 됨.
다음 포스트에서 noncovalent interaction들이 biomolecule에 얼마나 중요한지를 보여주는 예시들에 대해 조금 더 살펴보자.
'전공자를 위한 생물학 > 생화학' 카테고리의 다른 글
| [생화학] 1.5 : 물의 이온화(ionization) - 1 (0) | 2024.11.03 |
|---|---|
| [생화학] 1.4 : 삼투압(osmotic pressure) (0) | 2024.11.03 |
| [생화학] 1.3 : 비공유결합성 상호작용(noncovalent interaction) - 2 (0) | 2024.11.03 |
| [생화학] 1.2 : 수소결합(hydrogen bond) (0) | 2024.11.02 |
| [생화학] 1.1 : 물의 특징 (0) | 2024.11.02 |