이번 시리즈에서는 생화학의 개념들에 대해 하나하나 자세히 알아보도록 하자.
우선 이번 포스트부터는 생명체의 근원에 해당하는 물 분자에 대해 자세히 알아보자.
물 내부에 존재하는 생명들은 일단 UV light로부터의 protection을 받을 수 있음.
한편 많은 organism들은 70-90%정도 water를 함유하고 있음. 그러다 보니 생체 내에서 일어나는 chemical reaction들은 거의 모두 aqueous한 환경하에서 일어남. 이 밖에, 물은 protein, nucleic acid, membrane등의 structure와 function을 결정해주는 데에도 매우 중요하게 작용함.

물은 위와 같이 생김. 보면 가운데의 O가 4개의 sp3 혼성오비탈을 가지고, 이 중에서 2개의 혼성오비탈은 인접한 수소 원자와 전자를 pairing해서 공유결합을 형성하는 반면 나머지 2개의 혼성오비탈은 lone-pair electron을 가진 채로 남아있게 됨. 이 때 lone pair electron들이 나머지 혼성오비탈들을 밀어내는 효과를 발휘하게 되고 그 결과 원래는 tetrahedron이었던 구조가 찌그러져서 distorted tetrahedron 구조가 형성됨.
한편, O는 2번째로 큰 전기음성도를 가지고 있고, 그 결과 전자가 H로부터 O쪽으로 당겨져 오게 되어서 아래와 같이 O는 δ-, H는 δ+를 가지게 됨. 다시 말해, 물 분자 내부에는 강한 dipole moment가 형성되어 있음.

물 분자의 이러한 성질은 hydrogen bond가 가능하게끔 만들어줌.
일단 hydrogen bond, 즉 수소결합이란 전기음성도가 높은 F, O, N과 같은 원소들에 공유결합으로 붙어있는 H가 인근의 F, O, N의 lone pair electron과 서로 하게 되는 정전기적인 상호작용을 의미함.

참고로 이 때 hydrogen bond가 위 그림 왼쪽처럼 linear하게 형성되면(즉, N, O, F - H - N, O, F 3개의 atom이 일직선으로 배열) 세기가 가장 세지게 되고, 한편 위 그림 오른쪽과 같이 bending된 채로 형성되면 세기가 상대적으로 약해지게 됨.
그런데 물 분자는 흥미롭게도 H donor이면서 H acceptor이기도 해서 상당히 많은 수의 hydrogen bond를 형성할 수 있음.

위 그림에 나타나 있듯이, 물 분자 내의 H는 H donor로 역할을 할 수 있고, 물 분자 내의 O는 H acceptor로 기능할 수 있음.

특히나, 물 분자 하나에는 2개의 H acceptor(2개의 lone pair electron이 있으므로), 2개의 H donor가 있으므로, 위 그림과 같이 물 한 분자당 최대 수소결합 4개까지가 가능해지게 됨.
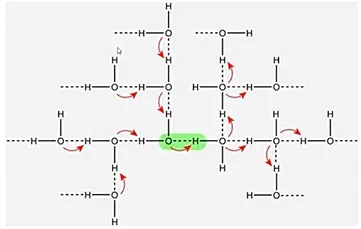
한편 위와 같이 물분자들이 서로 hydrogen bond를 형성하고 있는 과정은 매우 동적인데, 이는 물 분자 내에서 일어나는 분극 현상부터가 동적인 현상이기 때문임. 결과적으로 다양한 물분자들간의 hydrogen bond는 서로 cooperative하게 일어남.
그런데, O-H간의 공유결합의 세기(420kJ/mol)와 O - - H간의 hydrogen bond의 세기(20kJ/mol)를 비교해보면 거의 20배정도 공유결합의 세기가 더 세다는 것을 알 수 있음. 이는 공유결합이 너무나 센 결합이기 때문임. 다만 실제로 hydrogen bond의 경우도 분자간 상호작용중에서는 가장 강한 축에 속함.
다음 포스트에서는 수소결합(hydrogen bond)에 대해 알아보자.
'전공자를 위한 생물학 > 생화학' 카테고리의 다른 글
| [생화학] 1.5 : 물의 이온화(ionization) - 1 (0) | 2024.11.03 |
|---|---|
| [생화학] 1.4 : 삼투압(osmotic pressure) (0) | 2024.11.03 |
| [생화학] 1.3 : 비공유결합성 상호작용(noncovalent interaction) - 2 (0) | 2024.11.03 |
| [생화학] 1.3 : 비공유결합성 상호작용(noncovalent interaction) - 1 (0) | 2024.11.03 |
| [생화학] 1.2 : 수소결합(hydrogen bond) (0) | 2024.11.02 |