이번 포스트에서는 histone의 acetylation(아세틸화)에 대해 알아보도록 하자.
histone acetylation이 일어나면 gene activity가 변화한다는 사실은 Vincent Allfrey가 1964년에 처음으로 확인함.
우선 기본적인 histone acetylation 과정에 대해 먼저 알아보자.

보면 histone을 이루고 있는 amino acid들 중 lysine에 acetyl기가 붙게 됨. 이 때 원래 lysine에는 + charge를 띄는 R기가 붙어있음을 확인할 수 있는데, 그렇기에 원래 lysine은 histone이 + charge를 띄게끔 만들어서 - charge를 띄는 DNA와 잘 결합할 수 있도록 해주는 역할을 수행함(arginine도 마찬가지).
그런데 여기에 acetyl기가 달리게 되면 위 그림에서도 나타나 있는 것처럼 lysine 잔기가 중성화됨. 따라서 일반적으로는 histone acetylation이 일어날 시 DNA 가닥이 histone으로부터 조금 풀려 (transcription 관점에서)보다 더 active해짐.
한편 위 그림에 나타나 있는 것처럼 histone의 lysine 부분에 acetyl기를 달아주는 효소는 HAT(histone acetyltransferase)이며, 일반적으로 Acetyl-CoA로부터 acetyl group을 받아서 lysine에 달아주게 됨. (참고로 HAT은 1996년에 처음으로 발견됨)

이제 이와 관련된 실험 결과를 살펴보자. 일단 위 그림에 나타나 있는 gel 전반에는 histone이 다 섞여있는 상태임.
lane 1에는 세포 핵으로부터 추출한 단백질들을 쭉 다 loading시킴. 그 결과 매우 다양한 size의 band가 거의 연속적으로 나오는 것을 알 수 있음.
한편 lane 2에서도 앞서와 같이 단백질을 다 넣어주되, 이 때는 3H로 표지된 acetyl-CoA를 함께 넣어줌. 이후 나중에 unreacted acetyl-CoA를 washing해줌.
이런 과정을 거치게 되면 결국 여러 size의 단백질 군 중 HAT activity를 가지는 특정 단백질만이 acetyl-CoA로부터 radioactive한 acetyl기를 때서 gel에 전반적으로 퍼져있는 histone 중 일부에 붙여줄 수 있을 것임. 결과적으로 autoradiography를 통해 관찰하면 위 그림에서와 같이 특정 band가 관찰되게 되고, 55kDa size의 band에 포함된 단백질은 HAT 활성을 가진다는 것을 확인 가능함.
한편 histone acetylation은 cytoplasm과 nucleus에서 다 일어날 수 있음. 일반적으로 cytoplasmic acetylation은 HAT B에 의해 일어나고, core histone의 N-terminal tail에 일어나는 nuclear acetylation은 HAT A에 의해 일어남.
HAT B는 세포질에서 acetylation을 시켜주므로 대부분 histone이 ribosome에서 만들어지자 마자 바로 histone에 acetyl기를 붙여주게 됨. 그러나 HAT A는 핵 내에서 acetylation을 시켜주므로, 어떤 경우에는 이미 acetylation이 일어나 있는 histone을 또 다시 acetylation시켜야 하는 경우도 있을 것임.
이 때문에 HAT A는 HAT B와는 달리 bromodomain이라는 것을 가짐. bromodomain은 acetylated lysine을 인지하는 역할을 하며, 이 domain에 의해 HAT A가 acetylated histone 단백질을 인지하고 가서 이 histone에 추가적인 acetyl기를 붙여주게 됨.
참고로 bromodomain을 가지고 있는 다른 단백질들 또한 acetylated histone을 인식하고 recruit될 수 있는데 이 중 몇몇 단백질은 transcription에 essential하므로, 이런 방식의 recruit로도 acetylated histone 자체가 전사를 촉진시킬 수 있음.
histone을 acetylation시키는 녀석이 있다면 당연히 histone을 deacetylation시키는 녀석들도 있을 것임. histone deacetylation activity를 가지는 단백질들 중에는 transcription repressor와 관련된 녀석들이 많음. 즉, repressor에 의해 recruit된 corepressor들이 결과적으로 histone deacetylase들을 불러모아 주변의 histone을 deacetylation시켜 DNA가 더 condense되게 만들어버리는 일이 가능함. 참고로 histone deacetylase의 대표적인 예로는 HDAC1, 2가 있음.
이와 관련된 예를 살펴보자. 가장 대표적인 예는 앞서 살펴본 type II nuclear receptor system임.

보면 type II nuclear receptor의 일종인 RAR-RXR heterodimer가(이 경우 ligand와 결합하지 않은 상태이므로 repressor로 작동) co-repressor인 NCoR/SMRT를 recruit하고, 이 corepressor가 HDAC1을 recruit해서 결과적으로 HDAC1이 주변부의 histone을 deacetylation시켜버림. 그 결과 위 그림 아래와 같이 DNA와 histone이 더 잘 상호작용할 수 있게 되어 전사가 repression됨.
그렇다면 repressor, corepressor, deacetylase들이 모두 함께 붙어서 작용한다는 사실을 어떻게 알아낼 수 있을까. 가장 쉽게 사용할 수 있는 방법이 co-immunoprecipitation임. 참고로 co-IP의 모식도는 아래와 같음.
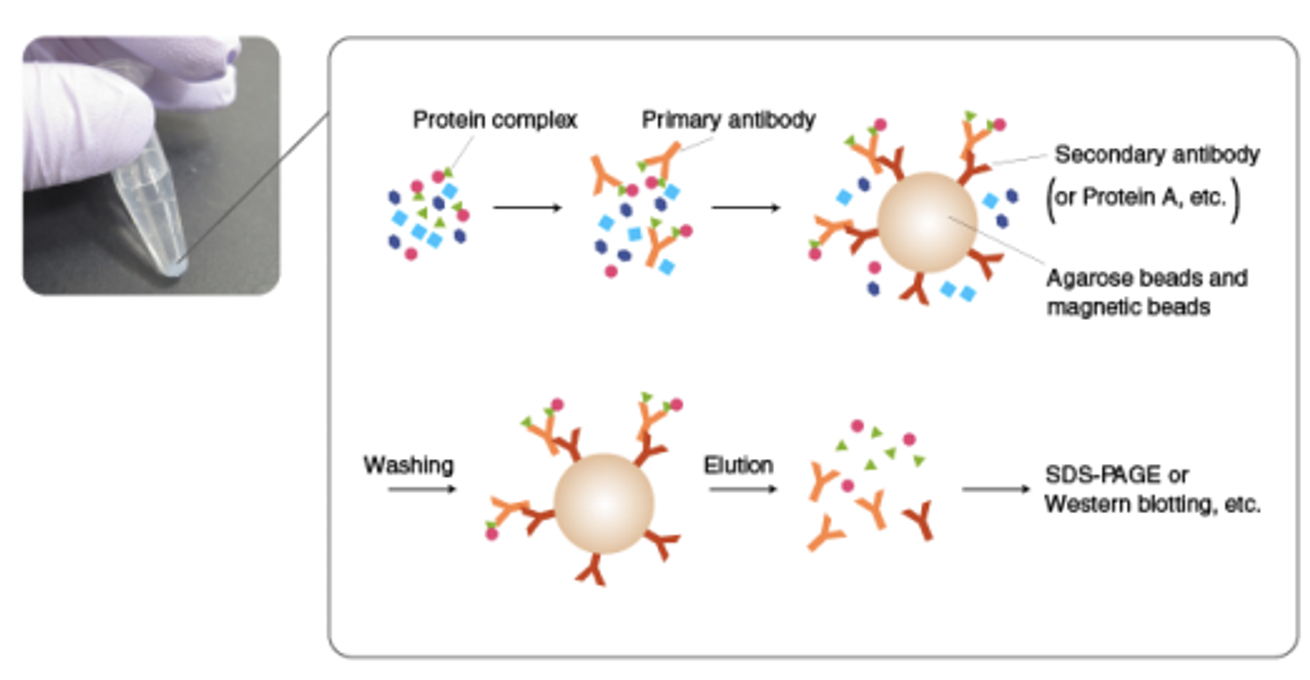
co-IP를 이용해서 HDAC2, SIN3A(corepressor의 일종), Mad1(repressor)의 3가지 단백질들이 서로 모여 complex를 이루는지 여부를 확인한 실험 결과가 아래와 같음.
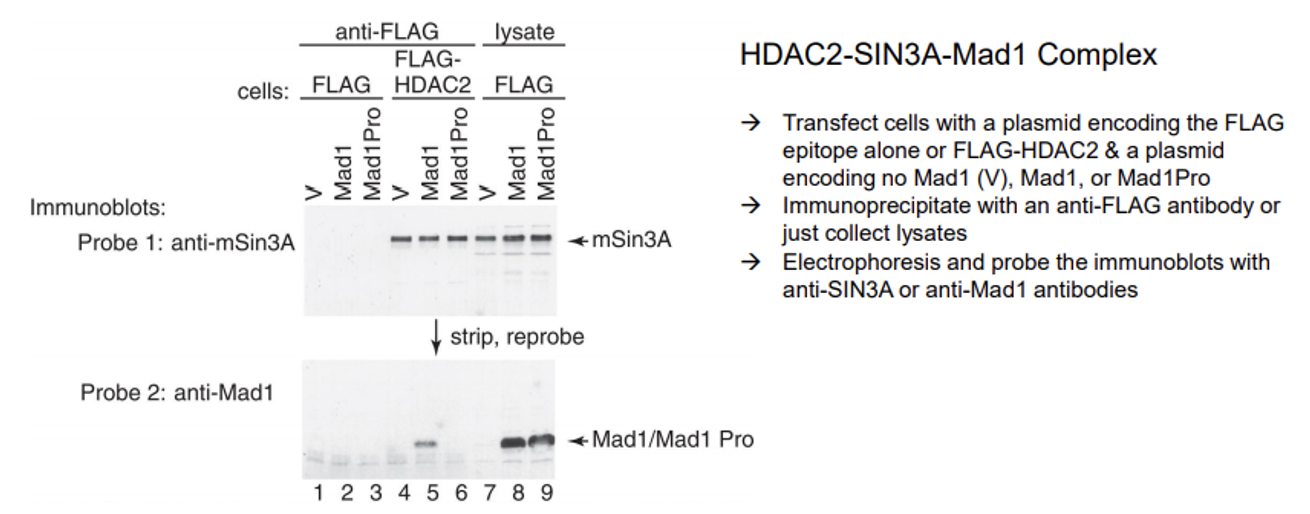
우선 IP를 위해 HDAC2에 흔히 사용하는 FLAG tag를 붙여줌. 이후 anti-FLAG를 이용해 co-IP를 수행함.
그 다음에 우선 anti-mSin3A probe를 이용해 immunoblot을 수행함. 그 결과 4, 5, 6번 lane에서 보이는 것처럼 모두 다 신호가 관찰됨. 이를 통해 HDAC2와 함께 SIN3A가 결합된 채로 co-IP되었음을 알 수 있음.
한편 anti-Mad1 probe를 이용해서 immunoblot을 한 경우, 5번 lane에서는 band가 관찰되었지만 6번 lane에서는 band가 관찰되지 않음. 5번은 Mad1(정상적인 repressor)을 넣어준 반면 6은 Mad1Pro(mutated repressor. 특히 얘는 Sin3A와 결합하지 못하도록 조작된 mutant Mad1임)를 넣어준 것을 감안하면, 앞서의 결과와 이 결과를 종합해서 생각할 시 SIN3A은 (band가 5, 6에서 다 나타났으므로) Mad1이 정상적이든 아니든 상관없이 자체적으로 HDAC2와 결합할 수 있으며, Mad1이 정상적일 경우 Mad1이 직접적으로 HDAC2와 바로 결합하지는 못하고 SIN3A와 상호작용해서 SIN3A-HDAC2 complex와 같이 붙는다는 것을 알 수 있음.
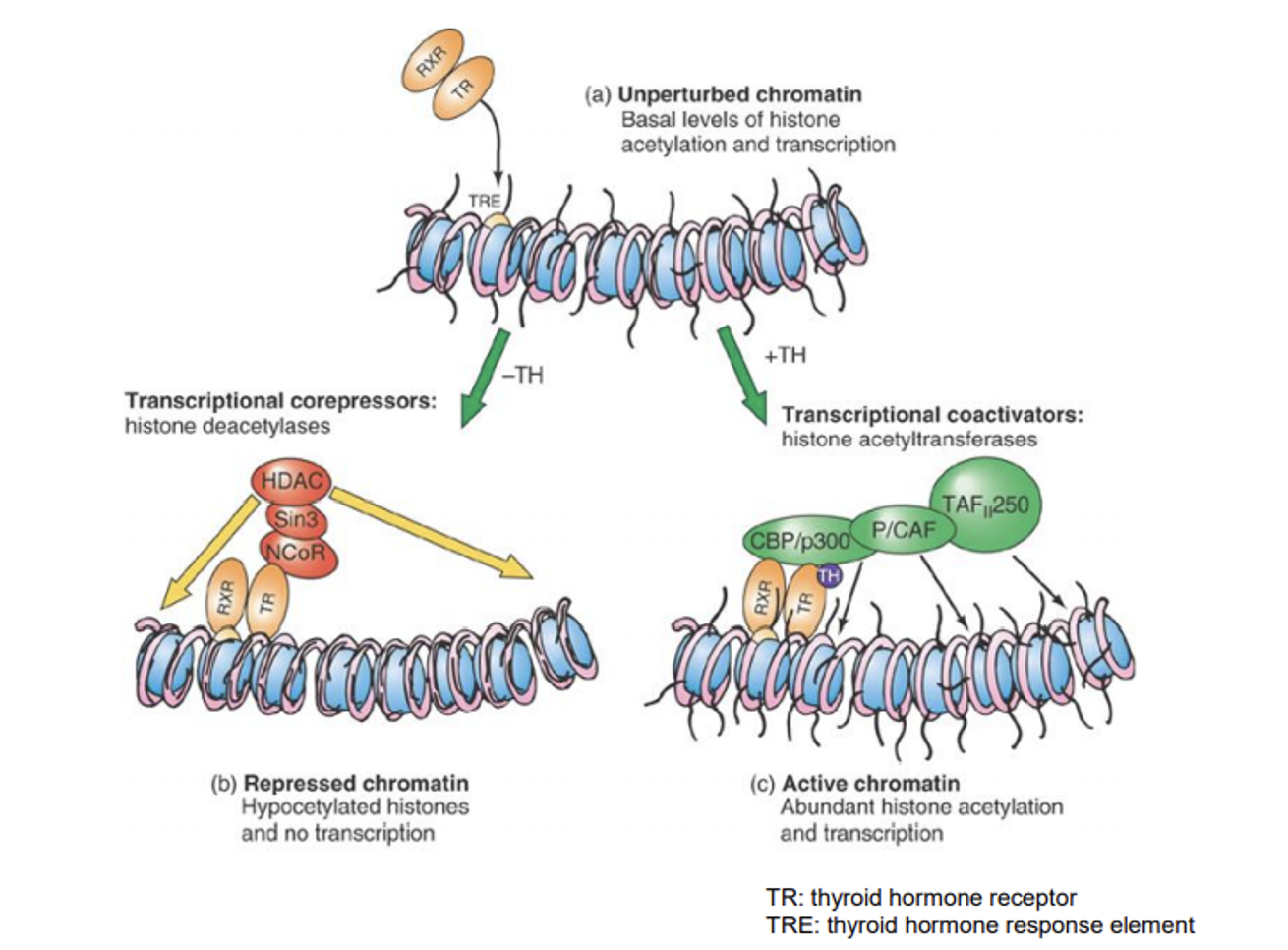
결과적으로 지금까지의 지식을 간단히 정리한 것이 위 그림임.
보면 repressor들의 경우 위 그림 왼쪽과 같이 각종 deacetylase들을 recruit하게 되고, 이 deacetylase들이 주변의 광범위한 영역에 작용해 결과적으로 전사를 억제하게 됨.
한편 activator(type II nuclear receptor의 경우 ligand를 만난 경우)들의 경우 때때로 acetylase들을 recruit하게 되고(위 그림에서 나타난 초록색 녀석들이 HAT activity를 가지는 녀석들임) 그 결과 전사가 촉진되게 됨.
'전공자를 위한 생물학 > 분자생물학' 카테고리의 다른 글
| [분자생물학] 13.7 : histone code (0) | 2023.12.18 |
|---|---|
| [분자생물학] 13.6 : chromatin remodeling (0) | 2023.12.18 |
| [분자생물학] 13.4 : nucleosome-free zone (0) | 2023.12.18 |
| [분자생물학] 13.3 : chromatin 구조와 유전자 발현의 관계 (0) | 2023.12.18 |
| [분자생물학] 13.2 : chromatin의 응축화 - 2 (0) | 2023.12.18 |