이번에는 번역 신장의 두번째 단계에 대해 알아보자.
elongation에서 두 번째 step은 바로 peptidyl transferase에 의한 peptidyl transfer임. 앞서 말한 것처럼 본 과정은 기본적으로 ribosome 내의 rRNA에 의해 유발됨. 이에 대한 증거가 아래 실험 결과임.
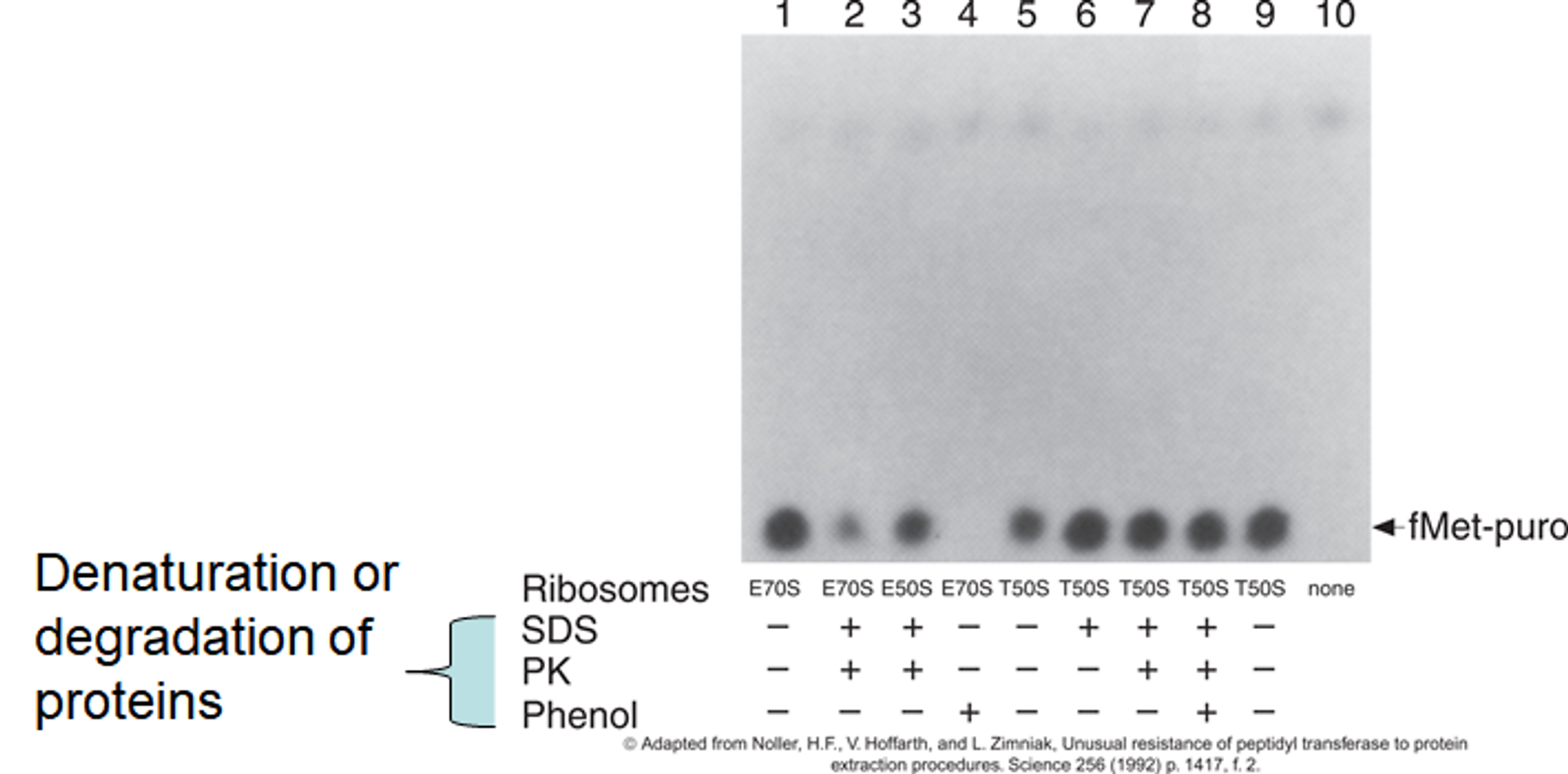
일단 본 실험에서는 fMet-puro 생성물의 양을 파악하는 assay를 통해서 fMet에 puromycin이 첨가되었을 때 정상적으로 peptidyl transfer가 일어나는지 여부를 확인함.
그리고 본 실험에서 사용한 두 가지 종류의 ribosome이 있는데, 바로 E70S와 T50S임. 전자는 E. coli로부터 유래했으며 후자는 thermophilic bacteria로부터 유래함. 일단 lane 1, 5를 통해서 ribosome(그 중에서도 large subunit)만으로도 peptidyl transfer가 일어난다는 것을 확인함.
한편 추가적으로 SDS, Phenol과 같은 denaturation chemical, 혹은 PK와 같은 degradation enzyme을 넣어줌. 이들은 기본적으로 protein을 분해한다는 공통점이 있음. (다만 phenol은 종종 RNA까지 분해해버리기도 함)
lane 2를 보면 실제로 E70S에 의한 활성이 SDS, PK에 의해 어느 정도 줄어들기는 했지만 그래도 일정 수준으로 유지되고 있음을 알 수 있음. 즉, 이를 통해 protein이 없더라도 RNA만으로 peptidyl transfer를 일으킬 수 있다는 것을 알 수 있음. 다만 lane 4를 보면 fMet-puro가 전혀 형성되지 않은 것을 볼 수 있는데, 이는 Phenol에 의해 RNA도 분해되어 버렸기 때문임.
한편 T50S의 경우에는 원래부터 조금 더 harsh한 환경에 살다 보니 RNA를 비롯한 전반적인 구조들이 다 rigid해서 lane 8에서와 같이 phenol을 넣어주더라도 RNA 분해가 거의 일어나지 않아 peptidyl transfer 활성이 계속 유지되고 있음을 알 수 있음.
실제로 E. coli의 경우 23S rRNA와 L2, L3 protein 만으로 peptidyl tranferase 역할을 수행할 수 있고, 그 중에서도 23S rRNA의 A2451이 catalytic center로 작용함.

위 그림에 A2451의 2' OH가 P site 내 tRNA 끝의 A 2' OH를 공격한 후, A site의 amino acid N 부위가 P site의 peptide C 부분을 nucleophilic하게 공격해서 결과적으로 peptidyl transfer가 일어나는 일련의 과정들이 나타나 있으므로 참고할 것.
한편 E. coli의 50S subunit에는 exit tunnel이 있음. 이 exit tunnel은 점점 합성되며 길어져가는 peptide chain이 바깥쪽으로 빠져나올 수 있는 통로임. 이 통로의 폭은 평균적으로 15 옹스트롬 정도 되며 protein의 α-helix가 딱 fit하게 빠져나올 수 있을 정도의 넓이임.
한편 단백질을 이루는 amino acid중에는 hydrophilic한 녀석도 있고 hydrophobic한 녀석도 있음. 이 중 hydrophobic한 녀석들끼리는 서로 hydrophobicity에 의해 뭉쳐서 덩어리를 만들어버릴 수 있고, 이 때문에 tunnel wall이 hydrophobic한 성분으로 이루어져 있으면 tunnel이 막힐 우려가 있어 곤란함. 따라서 tunnel wall은 hydrophilic한 RNA 만으로 이루어져 있음. (그렇기에 peptide가 smooth하게 tunnel을 통과할 수 있음)

위 그림에는 실제 exit tunnel과 이 tunnel을 통해 빠져나가는 peptide가 나타나 있음. 실제로 peptide는 위 통로를 빠져나가자 마자 넓은 공간을 마주하게 되므로 바로 folding이 일어나게 됨.
한편 우리는 ribosome의 구조를 잘 알게 되면서 이 ribosome을 targeting할 수 있는 수많은 항생제들을 개발할 수 있었음.

위 그림에 다양한 종류의 항생제가 나타나 있음. tetracycline의 경우 30S subunit에 binding한 후 tRNA와 ribosomal complex 간의 binding 자체를 block함. linezolid의 경우 50S subunit에 binding한 후 50S subunit과 30S subunit이 합쳐지는 것을 block함. chloramphenicol은 50S subunit에 binding한 후 peptide bond의 형성을 억제함. (즉, peptidyl transfer를 block함) macrolides, clindamycin, streptogramins는 50S의 exit tunnel을 block하여서 peptide chain이 exit tunnel을 빠져나가면서 자연스럽게 elongation되는 것을 block함. 마지막으로 Aminoglycosides(e.g. streptomycin)의 경우에는 30S subunit과 binding 후 mRNA codon이 잘못 읽히도록 해서 error rate를 높여 malfunctioning하는 protein이 생산되게 만들어줌.
즉, ribosome의 구조를 밝힌 것은 그 자체로도 의미가 있지만 방금 살펴본 것처럼 bacteria ribosome만을 target하는 새로운 항생제를 개발하는 데에도 공헌함.

이런 공로로 2009년에 ribosome 구조를 밝힌 과학자들에게 노벨 화학상이 수여됨.
다음 포스트에서는 번역 신장의 3번째 단계에 대해 자세히 알아보자.
'전공자를 위한 생물학 > 분자생물학' 카테고리의 다른 글
| [분자생물학] 18.3 : 번역 종결(translation termination) - 1 (0) | 2024.08.10 |
|---|---|
| [분자생물학] 18.2 : 번역 신장 (translation elongation) - 3rd step (0) | 2024.08.09 |
| [분자생물학] 18.2 : 번역 신장 (translation elongation) - 1st step (0) | 2024.08.09 |
| [분자생물학] 18.1 : 번역 신장 (translation elongation) - 2 (0) | 2024.08.09 |
| [분자생물학] 18.1 : 번역 신장 (translation elongation) - 1 (0) | 2024.08.09 |