이번 포스트에서는 저번 글에 이어 본격적으로 N antitermination 기작에 대해 더 자세히 알아보자.
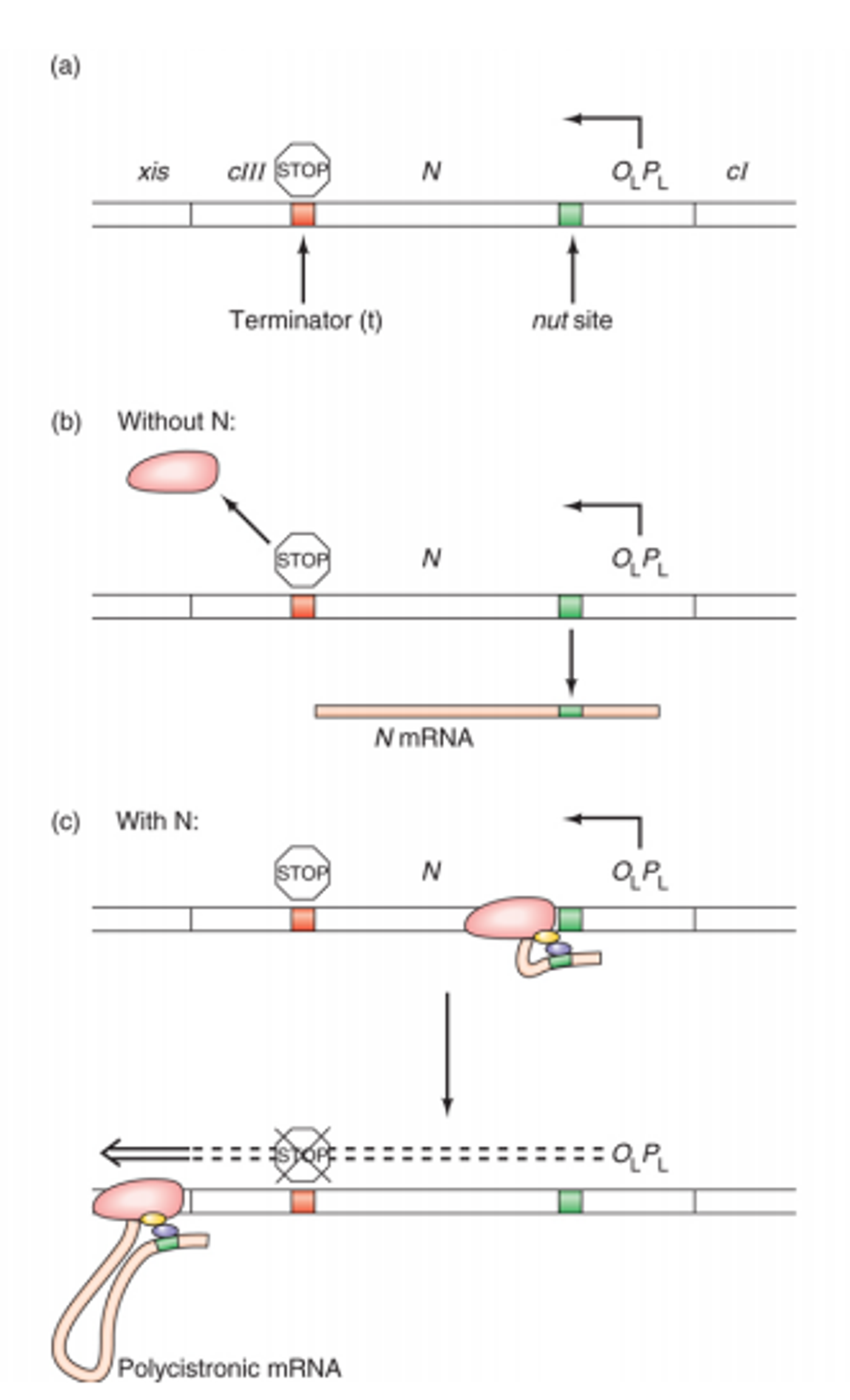
위 그림은 N이 있을 때 PL의 downstream에 있는 gene들이 antitermination되는 것에 대해 보여주고 있지만 실제로는 PR의 downtream에 있는 gene들에 대해서도 동일한 작용이 일어남. (이 때 위 그림에 나와있는 것과 같이 PL, PC와 동일한 위치에 OL, PR이 각각 존재하고 있음)
우선 기본적인 gene의 구성을 나타내주고 있는 (a)부터 살펴보자. 여기에는 OLPL의 아랫부분에 실제로 전사가 이루어지는 site들이 포진해있음을 나타내주고 있으며, 이 때 초록색으로 표시된 곳이 nut site임. (이 site의 역할에 대해서는 바로 이어서 살펴볼 것임) 한편 이후 N gene의 말단부에 intrinsic terminator를 형성할 수 있는 서열들이 존재함.
이러한 구성의 gene에서 N이 어떤 역할을 할 수 있는지 살펴보자. 우선 N이 없는 상황인 (b)부터 먼저 살펴보자. 이 때는 RNA polymerase가 OLPL에 붙은 후 쭉 N gene을 전사하다가 붉게 표시된 부분에서 terminator가 형성되어서 결과적으로 N mRNA만 생성되고 전사가 종결됨.
그런데 (b)의 결과물로 만들어진 N protein은 (c)와 같이 antitermination을 유발할 수 있게 됨. 이에 대해 구체적으로 살펴보자. 우선 N protein은 앞서 nut site로 표현되어있던 DNA로부터 만들어진 mRNA의 일부분(초록색)에 가서 달라붙을 수 있음. (이 때문에 초록색 site의 이름이 nut site[N utilization site]라고 지어진 것) 이후 모종의 반응을 거쳐 N mRNA와 N protein의 복합체는 RNA polymerase에 붙게 되고, 결국 이 녀석이 빨간 구간에서 termination되는 것을 억제함.
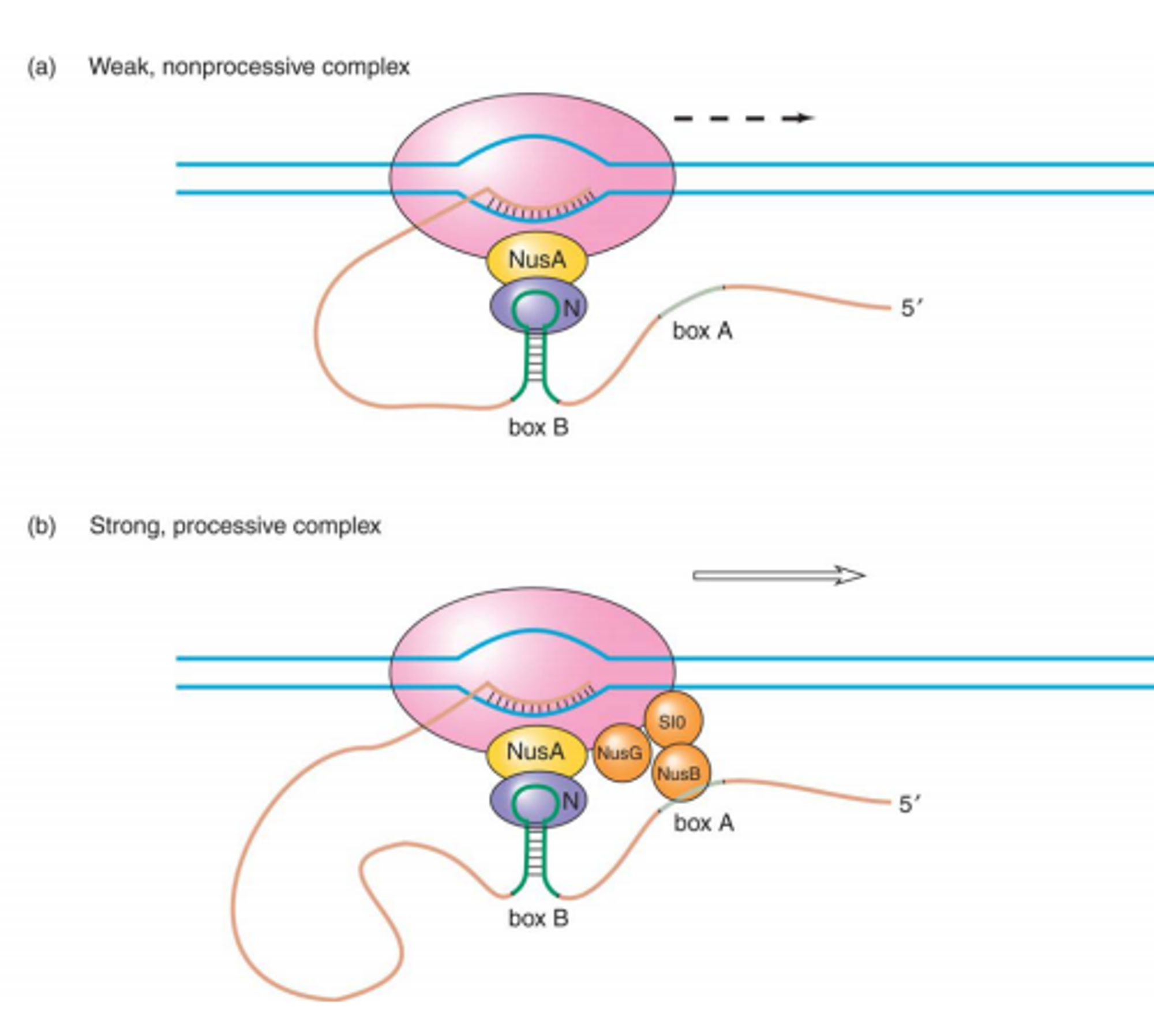
조금 더 구체적으로는 위 그림과 같이 complex가 형성됨. 이 때 N mRNA와 N protein의 복합체를 RNA polymerase와 붙게 해주는 녀석은 NusA라는 단백질임. 다만 NusA만 존재해서는 안정적인 복합체가 형성되지 않고, 위 그림 (b)와 같이 NusG, SIO, NusB와 같은 protein들이 추가적으로 붙으면 비로소 구조가 안정화됨. 이 때 N mRNA와 N protein을 제외한 다른 단백질들은 lambda phage로부터 유래된 것이 아니라 모두 host cell이 이미 가지고 있던 것들임. (물론 이처럼 antitermination의 용도로 가지고 있었던 것은 아닌데, phage가 자신의 용도에 맞게 이용하는 것)

위 그림은 그 중에서도 NusA가 host cell에서 원래 어떤 역할을 하는지를 나타내주고 있음.
이 때 분홍색으로 표현된 것이 RNA polymerase이며, 그 중에서도 RNA와 결합하고 있는 흰색 부분을 UBS라 함. 위 그림상에서는 UBS가 원래는 hairpin 구조가 형성되어야 할 inverted repeat 부위를 붙잡고 있는 형태임. 이 때 (a) 상황과 같이 RNA polymerase가 terminator를 만나게 되면 UBS와 RNA가 빠른 속도로 분리되고 이 덕분에 hairpin 구조가 생겨 termination이 일어남.
한편 (b)와 같이 RNA polymerase 중 UBS 주변에 NusA가 붙는 경우 NusA는 UBS와 RNA 사이의 결합을 더 빨리 끊어줘서 결과적으로 termination 과정이 더욱 빠르게 일어남. 즉, 원래 NusA는 termination을 빠르게 일어나게 해줌. 한편 (d)와 같이 UBS 주위에 N protein이 결합할 경우 UBS와 RNA 사이의 결합이 매우 느리게 끊어지게 되며 결과적으로 termination이 거의 안 일어나게 됨. 이에 더해 N protein은 자신의 결합부위 바로 근처에 NusA를 불러오게 되는데, 이 때 (e)와 같이 NusA까지 결합하면 이번에는 이 복합체가 UBS와 RNA 사이 결합을 더욱더 안끊어지게 해서 (hairpin 구조가 잘 생기지 않고) 결과적으로 termination이 거의 안 일어나게 됨. 이것이 바로 antitermination의 기본적인 원리임.
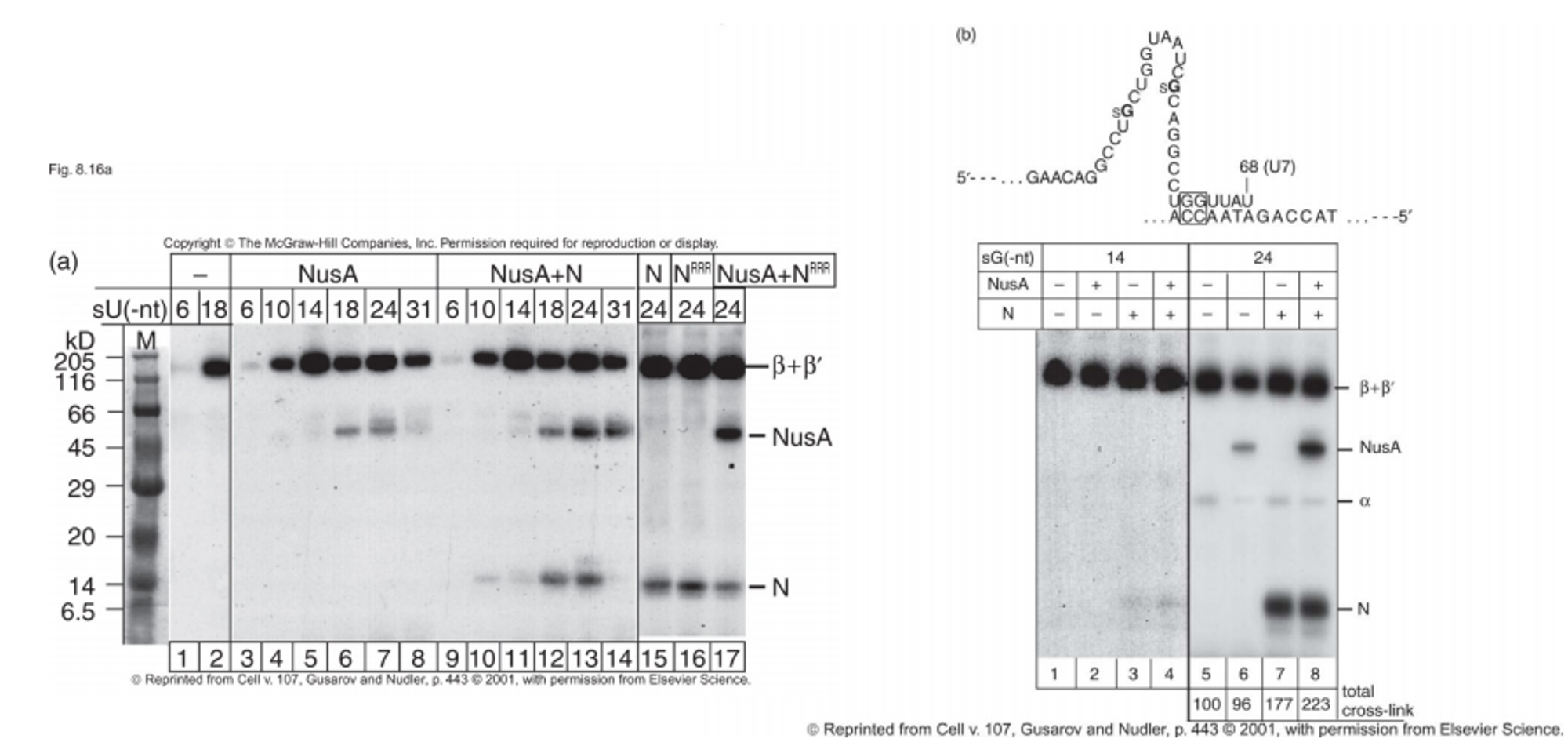
이제 이와 관련된 실험결과를 살펴보자.
이 실험의 목적은 RNA의 hairpin 부분에 어떤 단백질들이 붙는지를 확인하는 것임. 이 때 사용한 실제 RNA hairpin 근방 서열이 (b)의 맨 위쪽에 나타나 있음. 보면 일반적인 구조와 조금 다른데, hairpin 부분은 원래와 동일하지만 그 대신 UGGUUAU와 같은, UUUUUUU와는 다른 종류의 서열을 삽입해서 termination이 제대로 일어나지 못하는 상황을 만들어둠.
이렇게 가공한 이유는 UUUUUUU 서열이 hairpin 뒤에 존재할 시 in vitro 환경에서 termination이 너무 잘 일어나버리기 때문임. 따라서 poly U 서열을 조금 변형해서 실제 종결은 일어나지 않지만 hairpin은 만들어질 수 있도록 해줌. 한편 이 때 위 그림상에서 RNA의 3' 말단(U)를 -1로 두고 3'→5' 방향으로 숫자를 counting해주는 방식으로 각 서열들을 표시함. (전기영동 결과상에서 sU가 바로 이것을 의미함)
이 때 RNA를 labeling하기 위해 32P를 사용하였고, 이와 함께 thio-U도 사용함. thio-U는 UV를 쬐 줄 시 1옹스트롬 내에 있는 모든 녀석들을 다 crosslinking시켜버림. 따라서 특정 시점에서 존재하는 화합물 모두와 crosslink를 형성하게 됨. 이 때 RNA는 labeling되어 있으므로 단백질에 대한 electrophoresis를 진행했을 때 labeled band가 나타나면 이 단백질은 RNA와 결합했다고 판단하면 됨.
이 때 NusA, NusA+N을 넣어준 경우를 보면 -18~-24 사이 부근에서만 새로운 band가 관찰됨. 따라서 이를 통해 RNA의 -18~-24 부근에 NusA, N이 결합한다는 것을 알 수 있음. (참고로 (b)의 아래쪽에 나타난 결과의 경우 -14 부근에는 NusA와 N이 결합하지 않는 반면 -24 부근에는 NusA와 N이 결합한다는 것을 보여줌)
지금까지 N에 의한 antitermination에 대해 살펴봄. 지금부터 Q에 의한 antitermination에 대해 살펴보자.
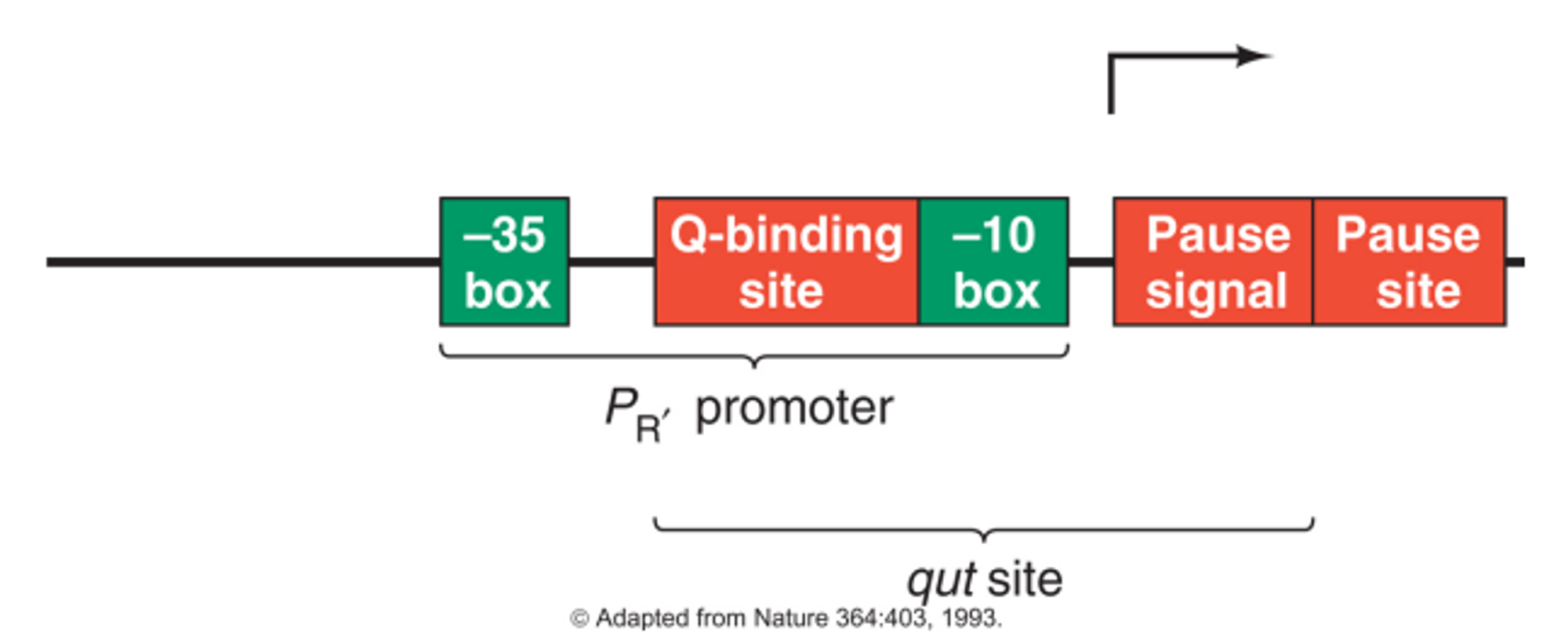
위 그림은 Q gene 앞쪽에 존재하는 PR' promoter 부위를 나타내주고 있음. 이 때 PR' promoter 내부에 Q-binding site가 존재하며, 이 Q-binding site를 포함한 일부 영역을 qut(Q utilization site) site라고 부름. 이 경우에는 N termination과 조금 다른 기작으로 antitermination이 일어남.
다음 포스트에서는 lysogenic reproduction에 대해 살펴보도록 하자.
'전공자를 위한 생물학 > 분자생물학' 카테고리의 다른 글
| [분자생물학] 9.1 : prokaryote에서의 repressor, DNA 상호작용 (0) | 2023.12.16 |
|---|---|
| [분자생물학] 8.3 : lambda phage(람다 파지), antitermination - 3 (0) | 2023.12.16 |
| [분자생물학] 8.3 : lambda phage(람다 파지), antitermination - 1 (0) | 2023.12.16 |
| [분자생물학] 8.2 : RNA polymerase switching (0) | 2023.12.16 |
| [분자생물학] 8.1 : sigma factor switching (0) | 2023.08.31 |