AAV 실험, 처음엔 막막하죠. 플라스미드는 민감하고, 정제도 어렵고, 타이트레이션도 귀찮은데 정확해야 하니까요.
저도 처음엔 그랬어요. 다행히 실험실 선배들과 여러 시행착오 덕분에 조금씩 익숙해졌고, 지금은 프로토콜 여백에 적힌 작은 팁 하나하나가 실험 효율을 좌우한다는 걸 실감하고 있어요. 이번 글에서는 제가 직접 겪고, 실험실에서 공유된 실전 팁들을 소개할게요.
플라스미드 단계 – ITR은 까다롭지만 대응법이 있어요
AAV의 transfer plasmid에는 ITR(inverted terminal repeat)이 들어 있어요. 이 ITR이 있어야 바이러스에 유전자가 실리는데, 문제는 이 구조가 굉장히 불안정해서 쉽게 삭제된다는 거예요. 특히 일반적인 37도에서 키우면 이런 문제가 더 잘 생겨요.
✔ 팁 1. 30도에서 키워보세요. ITR 안정성은 온도에 민감해서, 저온 배양이 도움이 돼요.
✔ 팁 2. NEB Stable 같은 recombination-deficient 균주 사용도 효과적이에요.
✔ 팁 3. SmaI/XmaI로 ITR 존재 확인은 필수예요! 미니프렙으로 먼저 확인 후, 미디프랩, 혹은 맥시프렙으로 넘어가면 시간도 아끼고 돈도 절약돼요.
트랜스펙션 단계 – PEI는 엑셀로 계산하고 여유분을 준비해요
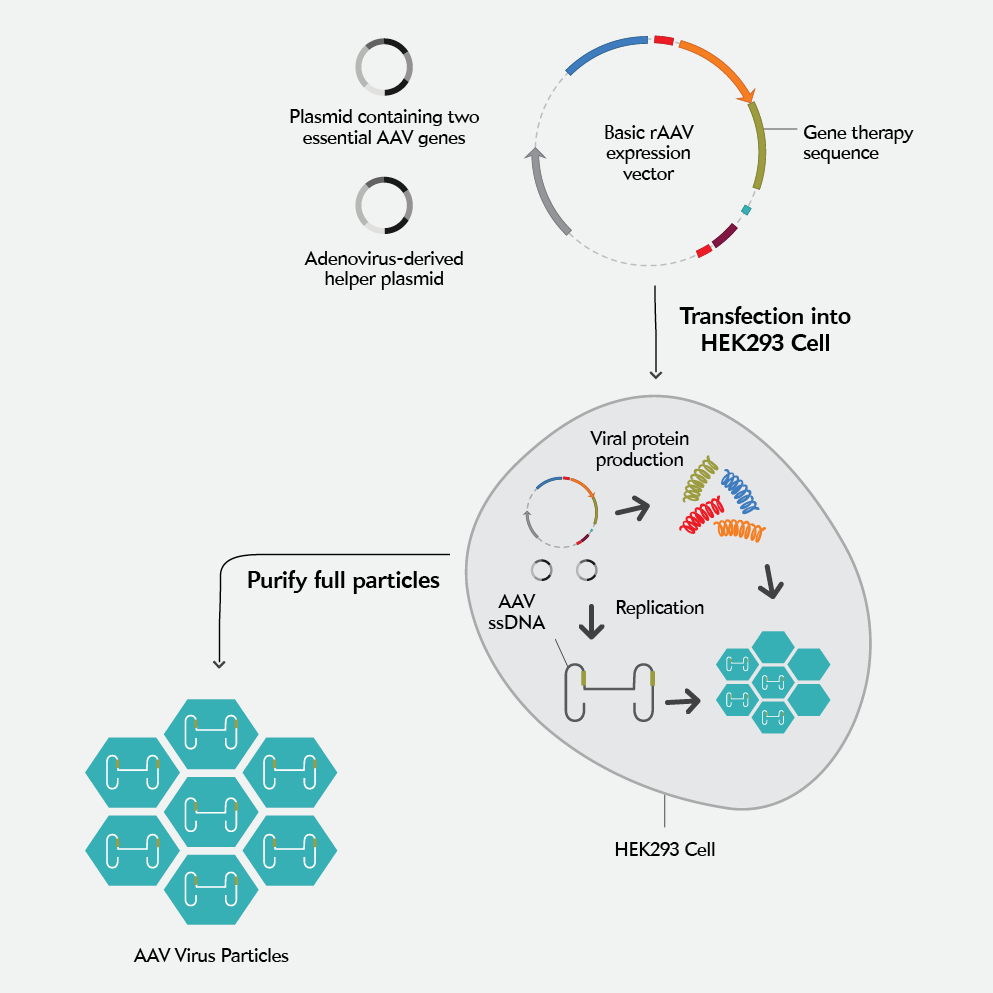
AAV 생산은 보통 트리플 플라스미드 트랜스펙션으로 진행돼요. RepCap, pHelper, transfer 플라스미드를 비율 맞춰 넣어야 하죠.
✔ 팁 4. 엑셀 시트로 PEI 양을 계산하세요. 플라스미드 양, 세포 수, PEI 농도까지 미리 정리해두면 실험 준비가 훨씬 쉬워요.
✔ 팁 5. 바이러스는 항상 여유 있게 만들기! 실험 도중 부족하면 새로 만들기 어렵기 때문에, 항상 넉넉하게 준비하는 걸 추천드려요.
정제 단계 – PEG 귀찮을 땐 생략도 가능해요

PEG 침전은 생산량을 늘려주긴 하지만, 용액 준비가 정말 귀찮아요. PEG는 뜨거운 자석 교반기에서 몇 시간 동안 녹여야 하고, 점성이 높아서 필터링도 어려워요.
✔ 팁 6. 시간 없으면 셀 펠렛만 수확해도 돼요. 실험 목적이 in vitro라면, PEG 없이 세포만 모아서 lysis 후 정제해도 충분한 경우가 많아요.
✔ 팁 7. 셀 파쇄는 얼음-에탄올 bath로 4번 냉동/해동하면 깔끔하게 끝나요. 소닉레이터 없을 때 유용해요.
타이트레이션 – 정확도가 중요해요!

✔ 팁 8. DNase 처리 꼭 하세요. 플라스미드 DNA가 타이트이션에 섞이면 실제보다 높게 나올 수 있어요.
✔ 팁 9. 바이러스 희석 단계에서 희석 배수를 정확히 기록하세요. 계산 실수로 역가가 엉망이 되는 걸 방지할 수 있어요.
✔ 팁 10. MOI는 매 batch마다 새로 최적화해요. 같은 프로토콜이라도 바이러스마다 결과가 달라요. 적정 용량을 찾기 위해 2~3가지 농도를 비교해보는 게 좋아요.
AAV 실험은 복잡하지만, 이런 작은 팁들이 쌓이면 정말 실험이 쉬워져요. 처음엔 긴장되고 손이 떨리지만, 어느 순간부터 ‘어? 이 정도는 이제 괜찮네!’라는 생각이 들게 되죠. 그때까지 하나하나 천천히 익혀가면 돼요.
다음 편에서는 AAV 벡터에서 가장 중요한 요소 중 하나인 ITR의 구조와 안정성에 대해 자세히 소개해드릴게요.
'전공자를 위한 생물학 > 대학원생을 위한 필수 생물학 개념들' 카테고리의 다른 글
| [AAV] 8편 : AAV ITR 실전 문제 해결 가이드 – 삭제, 돌연변이, 안정성 유지법 (0) | 2025.04.10 |
|---|---|
| [AAV] 7편 : AAV ITR 완전 정복 (0) | 2025.04.10 |
| [AAV] 5편 : AAV의 활용 – 실험실과 임상에서 다재다능한 유전자 전달 도구 (0) | 2025.04.10 |
| [AAV] 4편 : AAV 정제와 타이트레이션 – 깨끗하고 정확하게 준비하는 법 (0) | 2025.04.10 |
| [AAV] 3편 : 실험실에서 AAV를 만드는 방법 – helper-free 생산 시스템 (0) | 2025.04.10 |