이번 포스트에서는 ER에서 일어나는 단백질의 당화에 대해서, 그리고 잘못 접힌 단백질에 의한 UPR(unfolded protein response)에 대해서 알아볼게요.
이전 포스트에서 ER로의 단백질 수송에 대해서 살펴봤어요. 정리하자면, 세포 밖으로 분비될 단백질, 혹은 세포 막에 위치할 단백질들은 ER로 이동해와요.
그런데, 세포 내의 다른 소기관들과 비슷하게, ER도 막으로 둘러싸여있는 소기관이기 때문에, 세포의 나머지 부분과는 구분되는 독립적인 특징을 가지고 있어요. 그러다 보니 세포의 나머지 부분에서는 일어나지 않지만 ER에서는 일어날 수 있는 반응들도 많은데요.
그 중 가장 대표적인 것이 단백질의 당화(glycosylation)에요.

위 그림에서 위쪽에 접혀있는 부분이 단백질이고, 그 아래에 빨간색, 파란색, 초록색 구슬처럼 나타나 있는 것들이 '당'이에요. 이때 그림처럼 단백질과 당이 공유결합으로 아주 단단하게 연결되어있는 상태가 바로 당화에요. 특히나 위 그림처럼 아스파라진(Asn, N) 이라는 아미노산에 당이 붙는 반응을 N-당화(N-glycosylation)라고 불러요.
대다수의 단백질은 사실 단백질로만 존재하는 것이 아니라 이처럼 당화가 된 채로 존재하기 때문에, 당화가 되어있는지의 여부, 어떤 당이 붙어있는지에 따라서 단백질의 기능이 천차만별로 달라질 수 있어요.
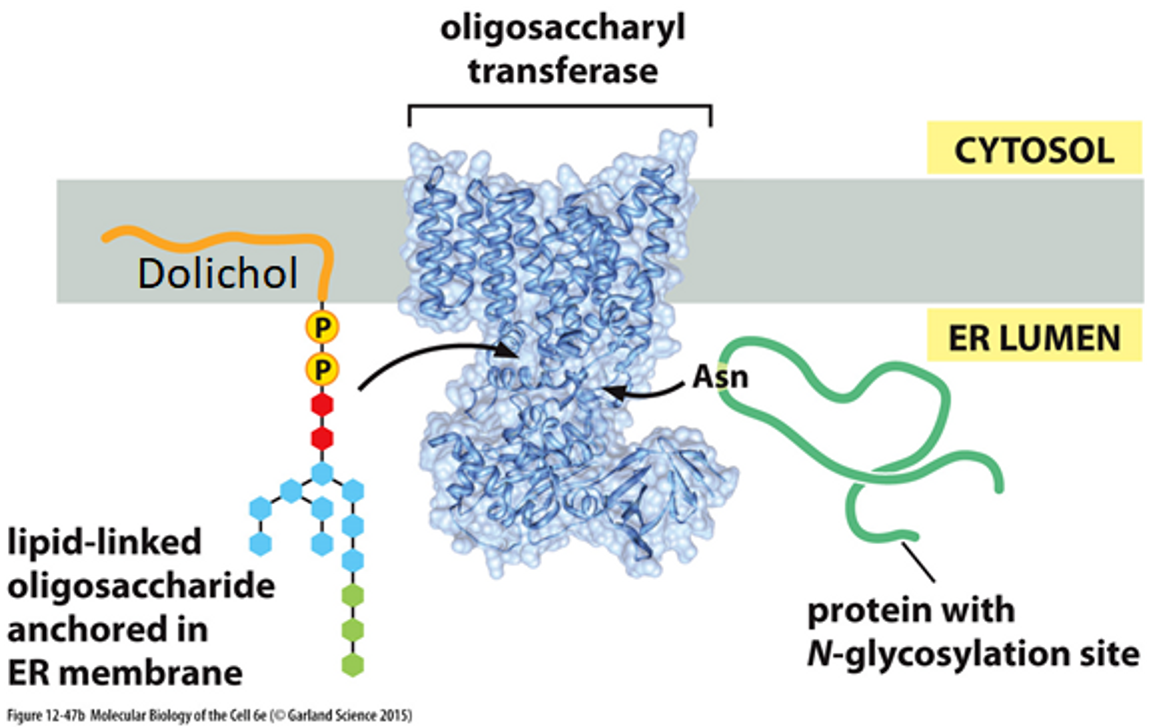
ER에서 일어나는 N-당화의 기작은 위와 같아요. 보면 ER 막에 있는 지질의 일종인 Dolichol(돌리콜)이라는 녀석이 있는데, 그림에도 나타나 있는 것처럼, 처음에는 이 Dolichol에 당 잔기들이 붙어있어요.
이후 ER 막에 있는 oligosaccharyl transferase(파란색)라는 효소에 의해서 Dolichol에 있던 당 잔기가 단백질, 그 중에서도 아스파라진(Asn)으로 옮겨가게 되어서 최종적으로 ER 내부에 있는 단백질의 N-당화가 이루어질 수 있어요.
그런데 여기에는 사실 설명하지 않고 넘어간 부분이 하나 있어요. Dolichol이 당 잔기를 전달하는 매개체인 것은 납득이 되지만, 그렇다면 애초에 당 잔기는 어디에서 온 것일까요?
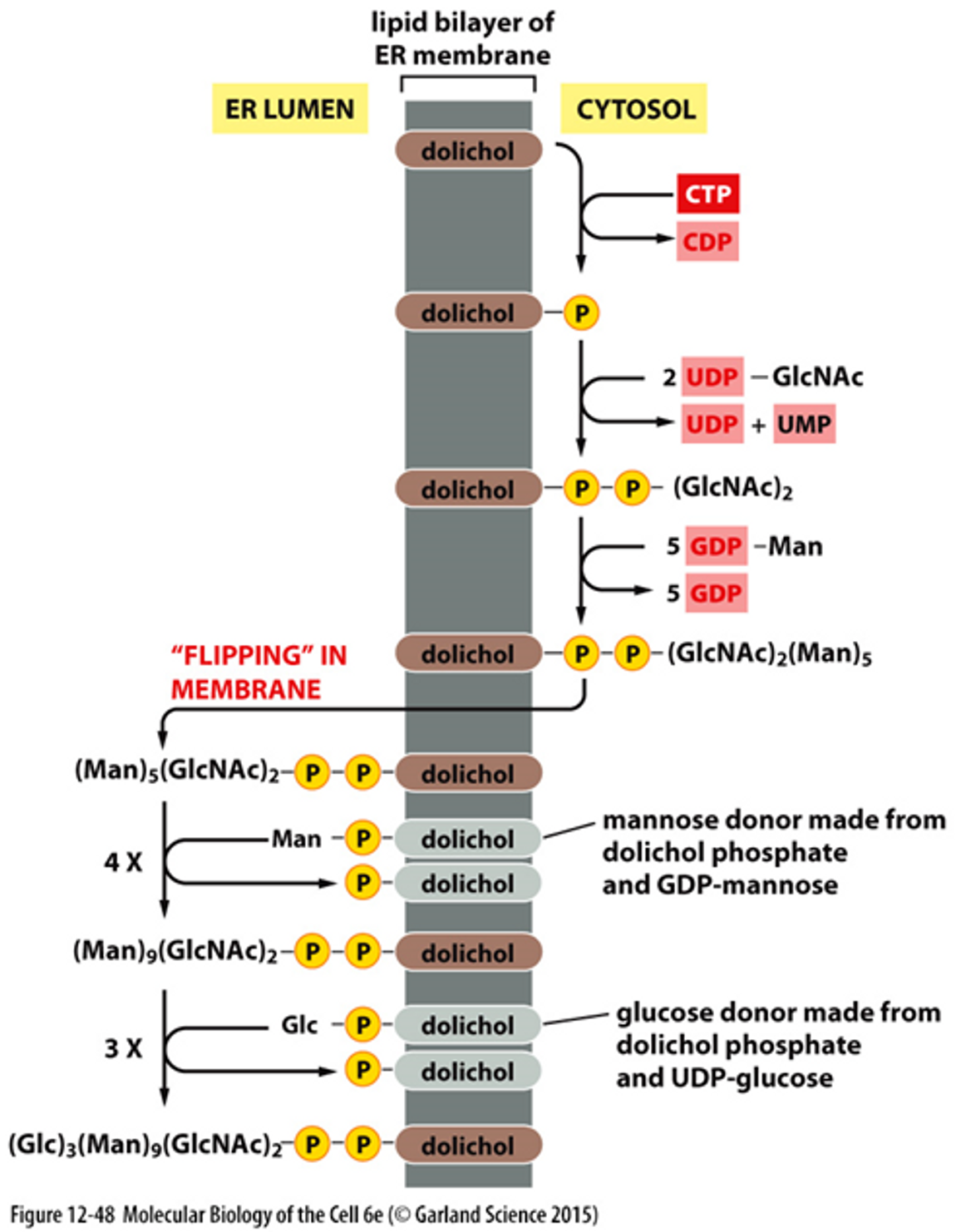
위 그림에는 당 잔기의 합성 과정이 나타나 있어요. 앞서 그림에서는 Dolichol에 붙은 당 잔기가 ER 안쪽 공간을 향해있었지만, 사실 처음 당 잔기가 합성될 때에는 위 그림처럼 세포질 방향으로 Dolichol이 향한 채로 당 잔기가 합성되고, 그 이후 flipping, 즉 Dolichol이 180도 뒤집어지는 반응이 일어나게 되면서 최종적으로 앞서 봤던 것처럼 당 잔기가 ER 안으로 향해있는 Dolichol이 만들어지는거죠. 여기서 Dolichol은 단순히 당 잔기를 합성할 때 발판 역할을 해주고, 이어서 단백질로 합성된 당을 통째로 옮겨주는 역할만 수행한다고 기억하면 충분해요.
한편, 이제 막 ER에 들어오고 당화가 된 단백질들은 자신의 구조를 제대로 형성하지 못하고 있어요. 보통 단백질은 저마다의 구조로 접힌 후 기능을 하기 때문에, 기능을 하는 단백질이 되기 위해서는 반드시 잘 접혀야만 해요.
(단백질이 제대로 접히지 않을 시 분해되어버리거나, 심지어는 분해되지 않고 덩어리진 채 남아서 질병을 일으키기도 해요. 대표적인 예가 바로 beta-amyloid의 덩어리짐에 의해 생기는 알츠하이머에요)
단백질의 접힘이 잘 일어났는지 여부는 온갖 곳에서 다양한 방식으로 검사되고 있는데요. 그 중에서 ER도 단백질의 접힘 여부를 검사하는 소기관 중 하나에요.

이와 관련된 기작이 위와 같아요. 하나하나 살펴볼게요.
1) 단백질의 당 잔기 끝으로부터 2개의 glucose 분자가 잘려나가고 1개의 glucose만 남음. (맨 왼쪽)
2) ER 막에 있는 calnexin이라는 효소가 1개의 glucose가 남아있는, 아직 제대로 접히지 않은 단백질을 잡아줌.
3) glucosidase라는 효소가 와서 남은 glucose 하나도 더 떨어뜨려버리고, 그러면서 protein이 calnexin으로부터 떨어져 다시 ER 안쪽 공간으로 오고, 이 상태에서 단백질의 접힘이 일어나게 됨. 이 때 만약 단백질이 적절히 접혔다면 이 단백질은 ER을 떠나 골지체로 이동하게 됨.
4) 그런데 만약 단백질의 접힘이 제대로 일어나지 않았다면, glucosyl transferase가 이를 인식한 후 glucose를 다시 한 개 붙여주게 됨. 그럴 시 이 단백질은 다시 calnexin에 의해 인식되어서 단백질이 제대로 접힐 때까지 2-3의 과정을 반복함.
이런 기작이 있기 때문에, 제대로 접히지 않은 단백질은 ER을 빠져나가 골지체로 가지 못하고 제대로 접힐 때까지 ER에 갖혀있게 되는거죠.
그런데, 이런 기작에도 불구하고 끝까지 제대로 접히지 않은 단백질들은 의미없이 남아서 이 과정을 반복하는 것보다는 제거되는 것이 더 효율적이겠죠?
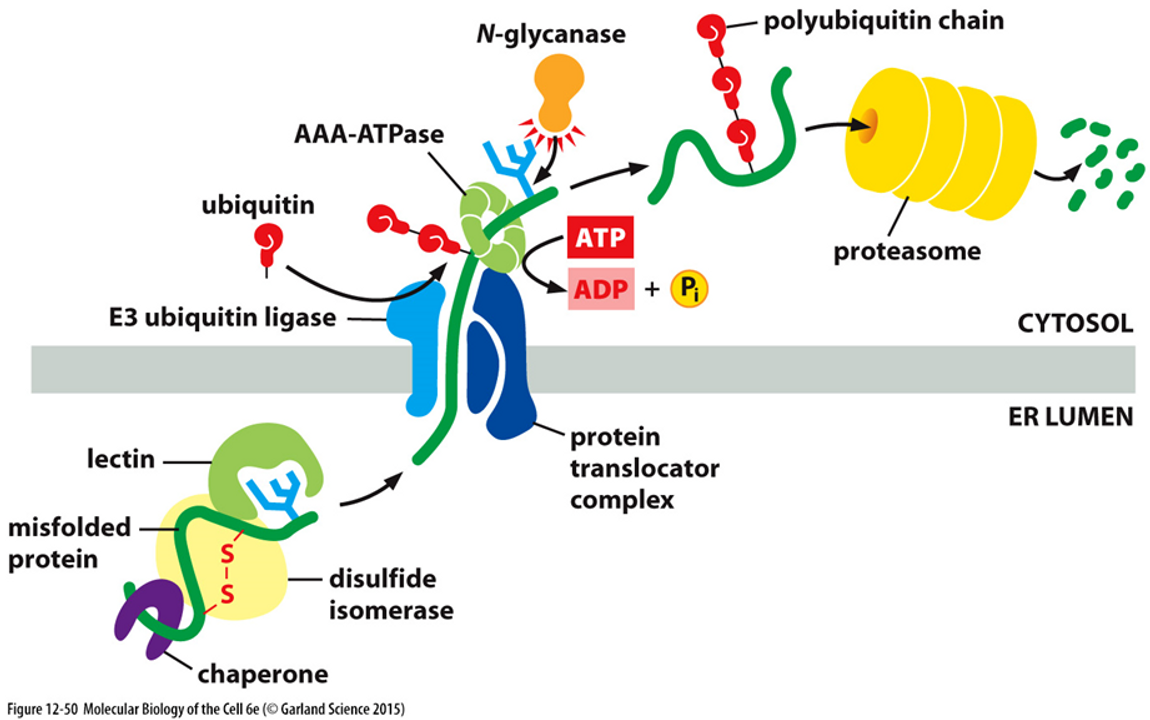
실제로 위와 같은 과정에 의해서 이런 단백질들이 제거돼요.
조금 더 자세히 알아보자면,
1) ER 내부에 있는 제대로 접히지 않은 단백질에 샤페론(chaperone)이 붙고, 이와 동시에 단백질의 당 잔기에 렉틴(lectin)이라는 단백질도 붙음. (일종의 인식 단계)
2) ATP를 써가며 ER 막에 있는 protein translocator complelx를 통해서 단백질이 세포질로 빠져나감.
3) 세포질로 나가면, 이 단백질에 유비퀴틴(ubiquitin)이 여러개 붙게 됨.
4) 유비퀴틴이 여러 개 붙은, 즉 polyubiquitination된 단백질을 proteasome이라는 단백질 복합체가 인식하고, 그 결과 단백질을 조각조각내버림.
이런 기작에 의해서 단백질을 분해해버려요. 참고로 유비퀴틴 여럿으로 표지된 단백질을 proteasome에 의해 제거하는 기작은 가장 잘 알려진 단백질 분해 기작 두개 중 하나에요. (나머지 하나는 lysosome에 의해 일어나는 autophagy에요)
그런데, 우리 세포는 항상 모든 상황에 대해 준비를 하고 있어야 하기 때문에, 이런 proteasome에 의한 분해 기작에 의해서도 도저시 해결 불가능한, 접히지 않은 단백질들이 너무 많이 존재하는 상황에서는 unfolded protein response(UPR)라는 반응을 통해서 대규모로 단백질 접힘을 유도할 수 있어요.

위 그림에는 각종 UPR 기작들이 나타나 있는데, 이런 UPR의 결과 ER 내부에서 단백질 접힘을 도와주는 각종 샤페론(chaperone)들, 재수송 단백질 등의 발현이 전반적으로 엄청나게 증가하게 되고, 그 결과 대규모로 단백질의 접힘이 촉진될 수 있어요.
참고로 위 그림상에 나타나 있는 3가지 단백질, IRE1, PERK, ATF6이 UPR 반응과 관련된 가장 대표적인 센서(sensor)에 해당해요. 그 중에서도 가장 잘 연구되어있는 IRE1을 예로 들어 조금 더 자세히 알아볼게요.
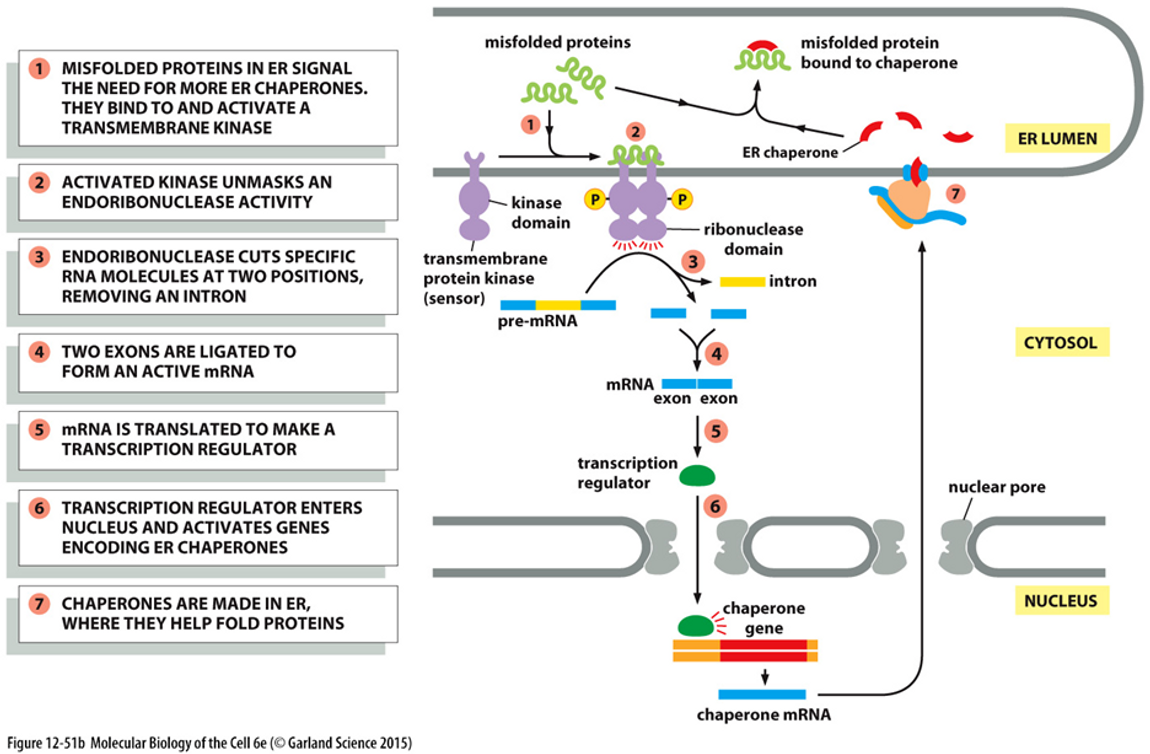
위 그림에는 IRE1에 의한 UPR 기작이 나타나 있어요. 하나하나 자세히 살펴볼게요.
1) ER 내에 잘못 접힌 단백질들이 많을 시 ER 막에 존재하는 transmembrane protein kinase에 잘못 접힌 단백질들이 결합하고, 그 결과 transmembrane protein kinase가 dimer(이량체)를 형성하는데, 이 형태를 IRE1이라 함.
2) IRE1 중 세포질 쪽을 향하고 있는 부분은 ribonuclease 활성을 가지는데, ribonuclease 활성이란 RNA를 자르는 활성을 의미함. 이 활성에 의해서 세포질 쪽의 mRNA를 적절히 잘라주게 되는데, 이 때 mRNA에 필요없는 인트론(intron)과 같은 서열들을 잘라줘서 mRNA의 성숙을 도와줌.
3) 성숙해진 mRNA가 번역된 결과 특정 단백질이 만들어지는데, 이 단백질은 다시금 핵 안으로 들어가서 샤페론 유전자의 발현을 촉진함.
4) 샤페론 단백질의 양이 많아지고, 이 샤페론 단백질은 이전 포스트에서 봤던 SRP에 의한 ER 수송을 거쳐 ER 내부로 들어감.
5) ER 내부에서 단백질 접힘이 대규모로 촉진됨.
마지막으로, 지금까지 살펴봤던 반응 이외에, ER에서는 지질막 또한 합성될 수 있어요.
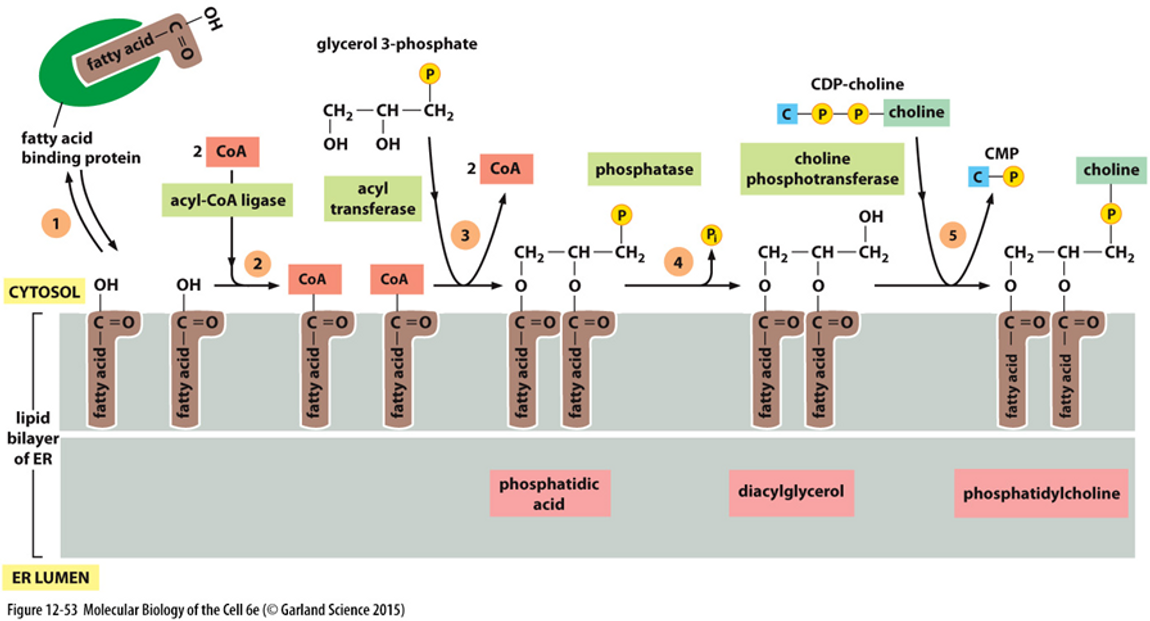
위 그림에는 실제로 ER에서 일어나는 지질막 합성 과정을 보여주고 있어요. 보면 세포질에 있는 지방산(fatty acid)들을 특정 단백질이 ER로 데려온 후 왼쪽에서 오른쪽으로 이어지는 연쇄적인 효소반응을 거쳐서 결과적으로 지질막이 합성되는거죠.

그런데 이 때 흥미로운 것은, 위 그림 왼쪽에 나타나 있는 것처럼 ER에서 지질막이 합성될 때까지만 해도 바깥쪽, 안쪽 지질의 조성이 동일해요. (여러 종류의 지질들이 무작위로 섞여 있어요) 그런데 이 막이 골지체를 거쳐서 세포막이 되는 과정에서 flippase와 같이 인지질을 특정 방향으로 뒤집어주는 효소에 의해서, 오른쪽과 같이 완전히 비대칭적인 이중막이 형성될 수 있어요.
이 비대칭적인 이중막은 아주 중요한데, 세포의 입장에서는 세포 안과 밖을 눈으로 구분할 수는 없기 때문에, 이런 비대칭적인 세포막이 안팎을 구분하는데 있어 아주 중요한 특징 중 하나로 작용해요.
이번 포스트를 끝으로 단백질의 수송에 대한 한 쳅터를 마무리할까 해요.
다음 포스트부터는 골지체로 이동한 단백질들이 어떤 운명을 맞이하게되는지에 대해 살펴볼게요.