이제 본격적으로 ETC 내부에서 typical하게 발견되는 electron carrier들에 대해 알아보자. 첫번째로 언급할 것은 NADH(nicotinamide adenine dinucleotide)임.
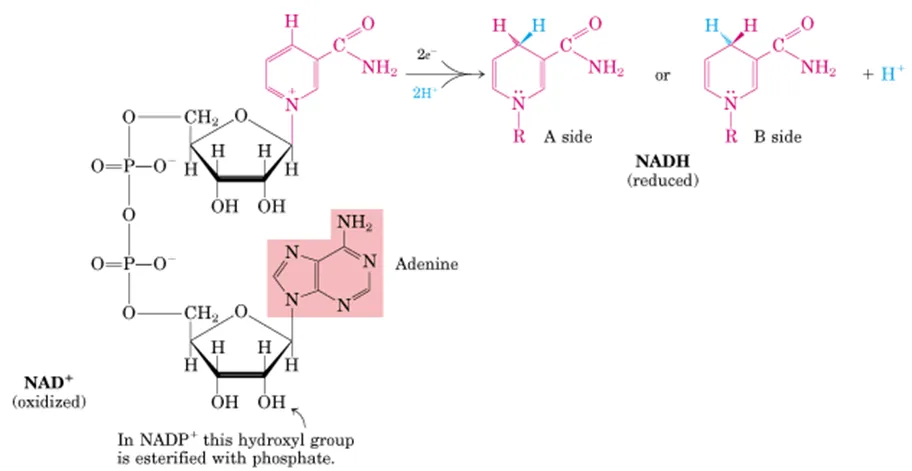
NADH는 위와 같이 생겼으며, 보면 niacin에 adenosine moiety가 첨가된 형태임. 이 때 adenosine의 당 부분, 그 중에서도 2번 탄소 부분에 phosphate가 하나 더 붙으면 NADPH가 됨. NADH, NADPH는 모두 soluble한 electron carrier이며, 특히 NADH는 NADH dehydrogenase에 의해 사용되게 됨.
위 그림을 보면 이 녀석은 2개의 전자, 2개의 수소이온을 input으로 받아 2개의 전자와 1개의 수소이온은 분자 내로 받아들이고, 나머지 1개의 수소이온은 그냥 빠져나가게 됨을 알 수 있음. 참고로 이 때 수소이온 1개가 들어가는 방향에 따라서 A side와 B side로 나눌 수 있음.
두 번째로 살펴볼 것은 FAD, FMN과 같은 flavoprotein들임. 이들의 경우 FAD, FMN 등을 prosthetic group으로 가지고 있는 단백질이며, FAD, FMN은 전자를 받아 reduction될 수 있음.

위 그림에 이들의 구조가 나타나 있음. 보면 FMN에 adenosine moiety가 첨가될 시 FAD가 됨을 알 수 있음. 이 때문에 이들 둘의 reduction potential이 약간 다름.
한편 이들 내부에 있는 isoalloxazine ring은 전자와 수소이온을 하나만 받은 채 semiquinone 상태로 존재할 수도 있고, 추가적으로 전자, 수소이온을 하나씩 더 받아서 fully reduced form인 FADH2, FMNH2가 될 수도 있음.
세번째로 살펴볼 것은 ubiquinone(coenzyme Q)임. 이 녀석의 경우 내부에 기다란 carbon chain인 isoprenoid chain을 가지고 있어서 (이 chain은 lipid가 가지는 acyl chain과 비슷해서 hydrophobic함) lipid-soluble함. (즉, membrane에 대해 soluble함)

이 녀석의 구조는 위와 같은데, 보면 우측 부근에 isoprenoid group이 있다는 것을 알 수 있음. 이 녀석의 경우에는 수소이온과 전자를 하나씩 받아 semiquinone radical의 형태로 존재할 수도 있고 추가로 수소이온과 전자를 하나씩 더 받아서 fully reduced form인 ubiquinol(QH2)이 될 수도 있음. 참고로 이들의 경우 isoprenoid chain에 의해 membrane에 잘 녹아들어있지만, membrane 바깥부분은 water-rich하므로 결국 membrane 안에서 존재할 수밖에 없음. 결국 ubiquinone은 membrane 안에서 diffusible하게 둥둥 떠다니는 형태임)
네번째로 살펴볼 것은 cytochrome임. cytochrome은 내부에 heme을 prosthetic group으로 함유하고 있는 protein임.

이 녀석의 일반적인 구조는 위와 같음. 보면 Fe가 주변의 N에 의해 상당히 stable하게 고정되어있는 것을 알 수 있음. 이 때 Fe가 전자를 잃어서 oxidized state로 가거나 전자를 받아서 reduced state로 가면서 electron을 carrying해주게 됨.
heme의 경우 위 그림과 같이 바깥의 functional group에 따라서 다시 a, b, c로 나누어짐. (물론 이들의 core structure는 모두 동일함) 이 중 특히 c를 보면 흥미롭게도 Cys residue가 존재함. 이 때문에 heme c의 경우 disulfide bond를 통해 단백질과 tight하게 결합한 채 존재할 수 있음. 한편 나머지 heme a, b의 경우 cytochrome 내에서 tight하게, 다만 non-covalent하게 결합하고 있음.
한편 이들의 functional group이 조금씩 다르다 보니 이들이 typical하게 흡광하는 파장 peak도 달라지는데, cytochrome a는 600nm에서 alpha peak이 보이고 cytochrome b는 560nm에서 alpha peak이 보이고, cytochrome c는 550nm에서 alpha peak이 보임.

한편, 위 graph처럼 같은 cytochrome c라 할지라도 reduced form인지 oxidized form인지에 따라서 흡광 pattern이 달라질 수 있는데, 보면 oxidize cytochrome c의 경우 γ에 비해 나머지 peak이 뚜렷하지 않으므로 peak ratio가 낮게 나오는 반면 reduced cytochrome c의 경우 γ뿐만 아니라 나머지 α, β peak도 뚜렷하게 나오므로 peak ratio가 높게 나온다는 것을 알 수 있음.
마지막으로 iron-sulfur protein에 대해 알아보자. 이들은 non-heme iron atom을 포함하고 있는 단백질임. 앞서 heme의 경우 딱 정형화된 틀의 가운데에 planar하게 철이 들어가있었다면, non-heme iron이 포함된 iron-sulfur에서는 amino acid, 그 중에서도 sulfur를 포함하고 있는 Cys에 의해서 iron이 coordination되어있는 형태임.
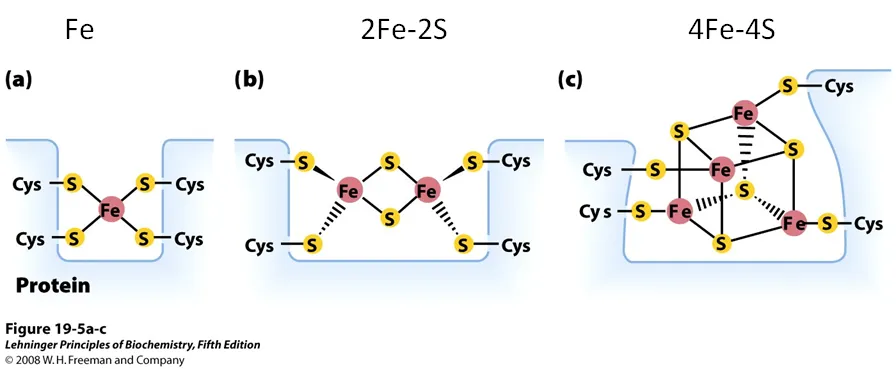
위 그림에 Iron-sulfur protein의 구조가 나타나 있음. 보면 Fe가 1개 포함된 경우, 2개 포함된 경우, 4개 포함된 경우 등 다양한 형태가 관찰될 수 있음. 다만 이 때 중요한 것은, 한 Fe를 coordination하는 S가 항상 4개라는 것임.
다음 포스트에서 이어서 살펴보자.
'전공자를 위한 생물학 > 생화학' 카테고리의 다른 글
| [생화학] 18.2 : 산화적 인산화 각론 - 1 (0) | 2025.03.31 |
|---|---|
| [생화학] 18.1 : 산화적 인산화(oxidative phosphorylation) - 3 (0) | 2025.03.30 |
| [생화학] 18.1 : 산화적 인산화(oxidative phosphorylation) - 1 (0) | 2025.03.29 |
| [생화학] 17.2 : 아미노산의 catabolism - 8 (0) | 2025.03.29 |
| [생화학] 17.2 : 아미노산의 catabolism - 7 (0) | 2025.03.29 |