이번 포스트에서는 nuclear hormone receptor에 대해 알아보자.
앞서 말했던 것처럼 nuclear hormone receptor는 주로 steroid 계열의 hormone들을 인식할 때 중요한 receptor들이고 이들의 경우 세포 막이 아니라 세포 내에 존재하고 있음.

보면 일단 steroid 계열 hormone의 경우 기본적으로 지용성이기 때문에 blood 내를 자유롭게 떠다니지는 못하고, 그 대신 serum binding protein과 같은 특정 protein에 binding된 form으로 운반됨. 그러다가 이 녀석이 세포막을 통과해 세포 안으로 들어오게 되면 nuclear receptor와 만나고, 이렇게 해서 형성된 ligand-receptor 복합체는 핵 안에서 HRE(hormone responsive element)라는 promoter 부위에 붙게 되고 결과적으로 특정한 gene의 transcription이 촉진되거나, 혹은 억제되게 됨.

참고로 위 그림 위쪽에 나타나 있는 것은 estrogen antagonist인 Tamoxifen이며, 이 녀석을 사용할 경우 estrogen receptor가 과발현되어있는 breast cancer를 치료하거나, 혹은 breast cancer 수술 후에 재발을 방지하는데 유용할 수 있음. 그리고 위 그림 아래쪽에 나타나 있는 것은 progesteron antagonist인 Mifepristone이며, 이 성분은 피임 관련 drug로 활용되고는 함.
다음으로, 이제 특정한 생명현상과 관련된 cell signaling 기작들에 대해 조금 더 알아보도록 하자.
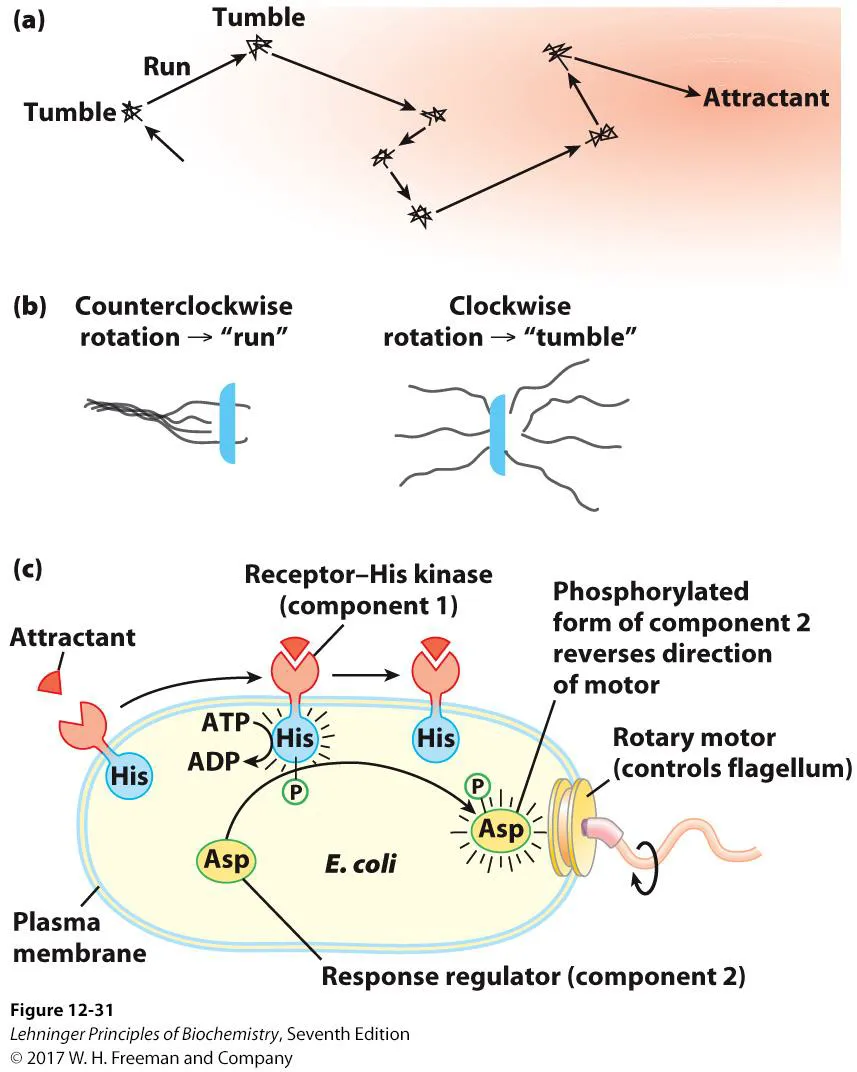
위 그림에는 bacteria의 chemotaxis 과정이 나타나 있음. 실제로 bacteria는 위 그림 (a)와 같이 주변 environment에 따라서 굉장히 dynamic하게 움직이고 있음. 이 때 특정한 방향으로 직선적으로 움직이는 run phase가 있고, 운동방향을 바꾸는 과정에서는 tumble을 하며 random move가 관찰된다는 것을 알 수 있음.
위 그림 (b)를 보면 실제로 flagella들이 counterclockwise로 돌게 될 시 이 녀석들이 자기들끼리 꼬이게 되고, 그 결과 run이 일어남. 한편 flagella들이 clockwise로 돌게 될 시 flagella 각각이 풀리게 되고, 그 결과 이 녀석들이 온갖 방향으로 퍼지게 되어서 이곳저곳을 random하게 움직이는 tumble이 일어남.
이런 식의 조절은 (c)와 같이 cellular signaling에 의해서 이루어지는데, 특정한 attractant가 receptor His kinase에 인지되게 될 시, 이 receptor는 세포 내부 부분에 His kinase domain을 가지고 있는데 이 부분이 인산화되어서 활성화되며 그 결과 response regulator(component 2)의 Asp residue가 phosphorylation됨. 이에 대한 결과로 rotary motor의 형태가 변해 counterclockwise의 rotation이 일어나게 됨.

다음으로 cell cycle과 밀접한 관련이 있는 cyclin, CDK system에 대해 알아보자. 사실 Cyclin과 CDK는 complex 형태로 같이 작동하게 되는데, 이 때 Cyclin은 regulatory subunit 역할을 하고 CDK는 catalytic subunit 역할을 함.
그리고 위 그림 오른쪽 아래를 보면 cell cycle에서 어느 시점에 와있는지에 따라서 존재하는 cyclin, CDK 조합이 달라지게 됨. 특히 cycle의 특정 시점에서만 특정 cyclin이 관찰된다는 것을 알 수 있는데, 이러다 보니 이 녀석의 이름을 cyclin이라 붙이게 된 것.

처음에 특정 CDK와 잘 결합할 수 있는 cyclin이 딱 만들어지게 되면, 그 결과 cyclin-CDK 복합체가 생김. 그런데 이 상태로 그냥 activation이 되는 것은 아님. 위 그림 3을 보면 Tyr부분에 인산기가 붙어있는 상태에서는 inactive함. 그러다가 Thr160번이 인산화되는 반면, Tyr 부분의 인산기는 떨어져나가게 되면 비로소 cyclin-CDK complex가 active해짐. (이런 과정에 의해 protein kinase인 CDK 내부에 있는 ATP binding site가 open되고, 한편 substrate가 붙을 수 있는 부분을 가로막고 있던 activation loop은 치워지게 되어서 그 결과 CDK의 kinase activity가 on되게 됨)
한편 이 때 Tyr에 있던 인산기를 때내주는 역할을 하는 녀석이 phosphatase임. 이 phosphatase는 인산기가 붙어있는 형태일 때 active하게 작용함. 한편 흥미롭게도, 그 결과 생성되는 active한 form의 cyclin-CDK 복합체의 기질 중 하나가 또 phosphatase임. 그러다 보니 이 과정에 의해 더 많은 phosphatase가 인산화되고, 활성화되어 더 많은 Cyclin-CDK가 활성화되는 positive feedback loop이 형성되게 됨.
그러다가 충분히 Cyclin-CDK 복합체가 제기능을 하고 난 뒤, Cyclin-CDK 복합체에 의해 DBRP(destruction box recognition protein)도 인산화되게 됨. 이 때 인산화된 DBRP는 Cyclin 내부의 destruction site와 binding한 뒤 Cyclin에 Ubiquitin chain을 붙여주게 되고, 그 결과 cyclin은 UPS에 의해 degradation되어서 CDK가 off 상태로 존재하고 있게 됨. 이후 계속 cycle이 진행되다가, 다시 특정한 시점이 되면 특정 cyclin의 expression이 증가하게 되어 앞서의 과정이 계속 반복되게 됨.
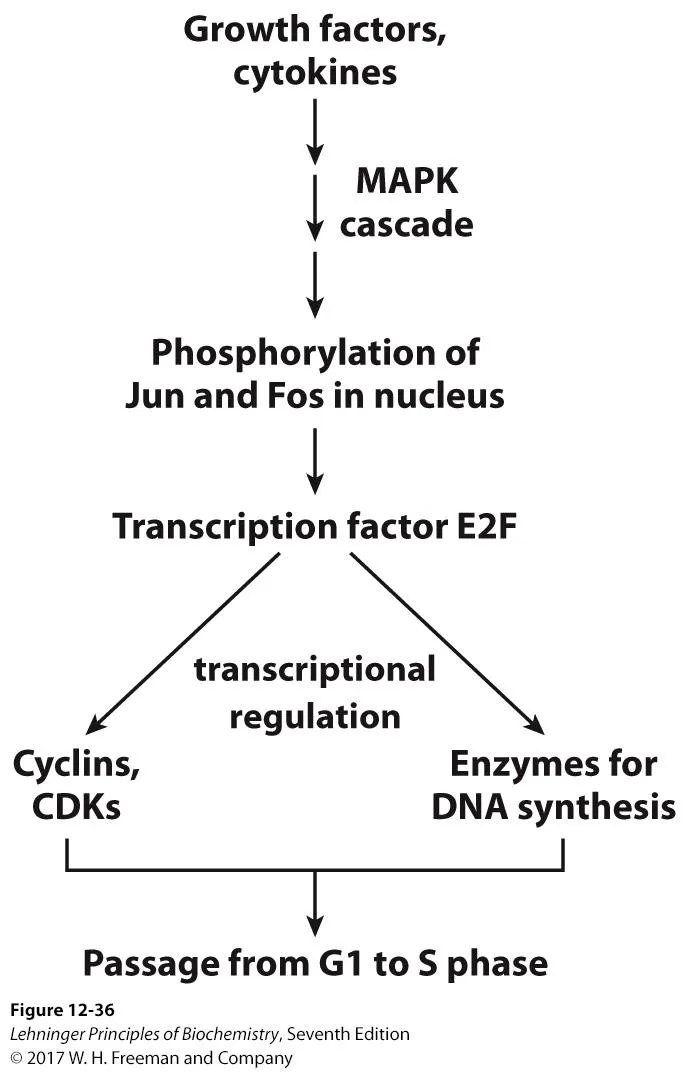
한편, 위와 같이 growth factor, 혹은 cytokine에 의해서 MAPK cascade가 on될 경우 결과적으로 nucleus 내부에 있는 Jun, Fos가 인산화되어 activation됨. 그러면 이 녀석에 의해 결과적으로 E2F라는 transcription factor도 activation됨. 이렇게 해서 활성화된 E2F는 앞서 살펴봤던 특정한 Cyclin, CDK의 expression을 촉진하게 되고, 그런 한편 세포 분열을 하기 위해 필수적으로 일어나야 하는 DNA synthesis 과정에서의 enzyme expression을 촉진하게 됨.
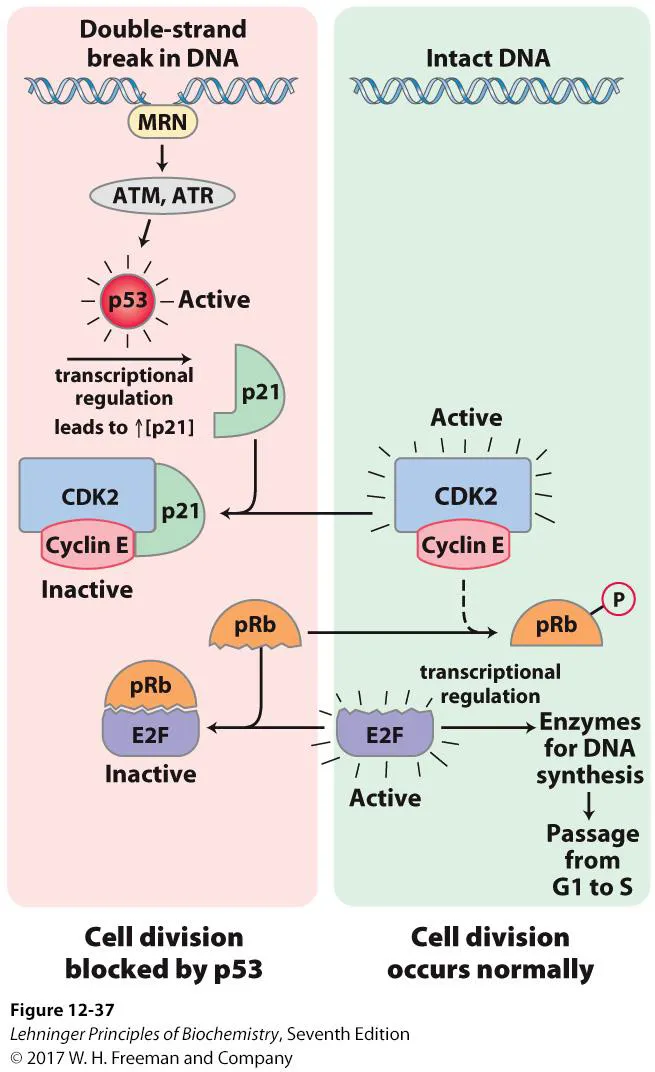
그리고 cell cycle의 조절과 관련해서도 위와 같이 아주 흥미로운 pathway가 존재함.
우선 DNA가 intact하게 잘 존재해서 cell division이 정상적으로 일어나는 오른쪽의 경우를 보자. 이 경우 CDK2와 Cyclin E가 복합체로 존재하며 active하게 작용해서 pRb라는 유명한 tumor suppressor protein을 인산화시켜 불활성화시키게 됨. 원래 pRb는 E2F와 서로 결합한 상태로 존재해서 일종의 E2F sequester로 작동했었는데, pRb의 인산화에 의해 pRb가 inactivation되게 되면 결과적으로 active해진 E2F는 앞서 봤던 것처럼 각종 gene의 expression을 조절해주는 transcription factor로 기능하게 됨.
한편 DNA의 double-strand break가 있는 경우에는 위 그림 왼쪽과 같은 일이 일어남. 보면 double-strand break를 인지하고 결합한 ATM, ATR kinase에 의해서 p53이라는, 또 다른 유명한 tumor suppressor protein이 인산화되어 activation되게 됨. 그럴 시 p53은 다시 핵으로 들어가 transcriptional regulator로 작동하고, 그 결과 p21이라는 녀석이 많이 만들어지게 됨. 이렇게 만들어진 p21은 CDK2-CyclinE 복합체에 붙어 이 복합체 전체를 inactive하게 만들어줘버림. 그 결과 pRb가 인산화되지 않게 되어서 pRb가 E2F를 sequester하게 되고, cell division이 일어나지 않게 됨. 이러한 G1 arrest 기작은 DNA가 intact하게 복구되었을 시, 혹은 세포가 다시 cell division을 시작할 준비가 되었을 시까지 계속 이어지게 됨. (이는 불완전한 form의 유전체를 후손세포에게 물려주지 않게 하기 위한 cell의 전략임)
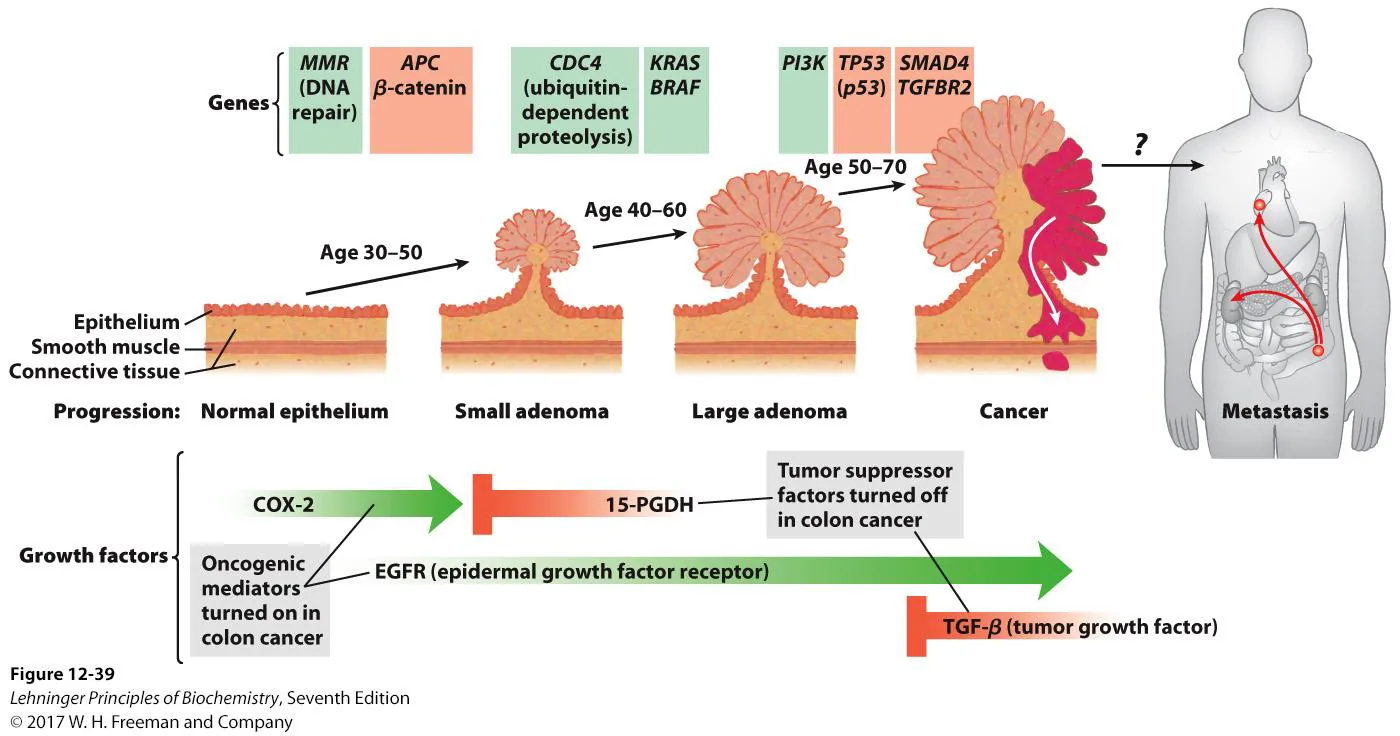
다음으로 cancer에 대해 간단하게 알아보자. cancer는 위 그림에서 나타나 있듯이 oncoprotein들(녹색)의 overexpression, 혹은 tumor suppressor protein들(주황색)의 knockout에 의해서 발생할 수 있음. 다만 하나의 gene mutation만으로 cancer가 만들어지는 것은 아니며 다양한 mutation이 잘 누적되어야만 cancer가 될 수 있는 것임. 참고로 이 때 tumor는 일단 세포가 조절이 되지 않으며 많이 분열하는 덩어리를 의미하고, cancer는 tumor 중 실제로 기능이 망가진 경우를 특별히 의미하는 경우가 많음.
방금 알아본 것처럼 protein kinase는 암, 그리고 그 밖의 질병들에 있어 상당히 중요한 역할을 함. 그러다 보니 protein kinase inhibitor를 이용해 drug를 만들고자 하는 시도가 많이 있어왔음.
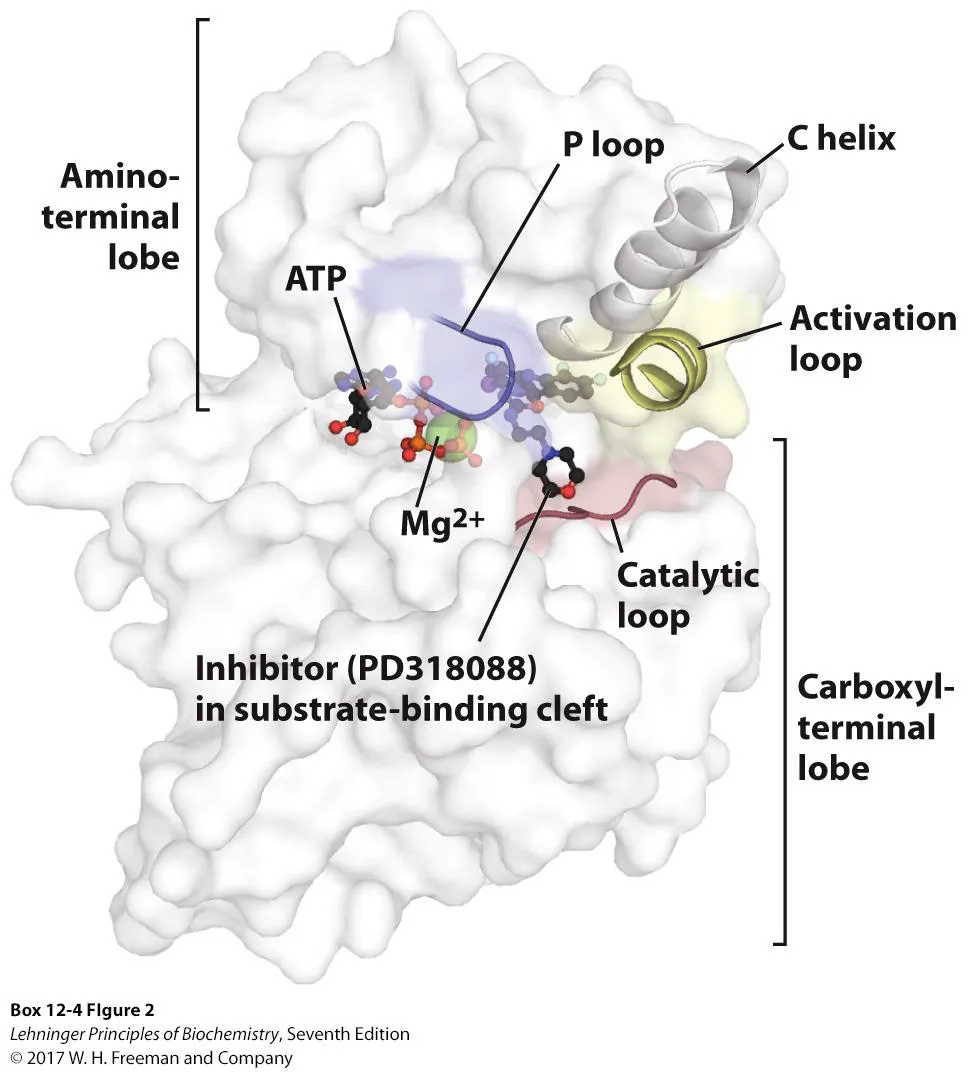
위 그림은 MEK kinase의 구조를 보여주고 있음. 보면 ATP binding pocket이 있으며, ATP가 binding한 뒤 작용하는 P loop가 존재하며, 인산화를 시켜주는 catalytic active한 catalytic loop가 존재하며, activation loop도 존재해서 substrate의 binding을 block해주고 있음. 따라서 protein kinase inhibitor를 개발하고자 한다면 이런 식의 protein kinase 구조를 고려해야 할 것임.
과거에는 그냥 ATP analog를 protein kinase inhibitor로 사용함. 그런데 이 경우 ATP binding pocket은 모든 protein kinase들이 가지고 있기 때문에 이런 방법으로는 우리가 원하는 특정 종류의 protein kinase만을 inhibition시키는 것이 불가능함.
그래서 사람들은 많은 전략들을 개발함. 한 예로 ATP binding site와 함께, 그 옆쪽의 protein kinase specific한 region을 함께 cover하는 drug를 개발하거나, 혹은 inactive protein kinase에 작용해 active하게 못가게 하는 drug를 개발하거나(실제로 active한 녀석의 catalytic cleft는 다 비슷비슷한 반면 inactive할때는 종류에 따라 모양이 제각기 다름), 혹은 아예 therapeutic antibody를 개발하는 식의 방법이 많이 시도되고 있음.
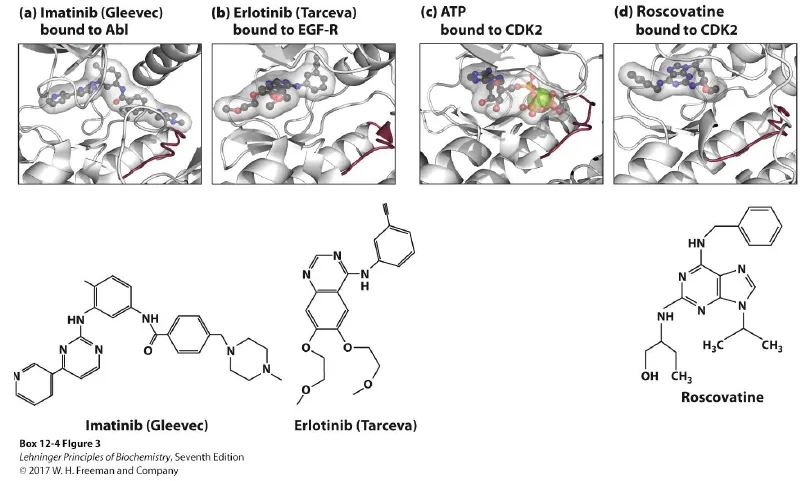
위 그림 왼쪽 아래에는 Gleevec이 나타나 있음. 이 drug는 Bcl-Abl이라는 kinase를 inhibition하여 혈액암의 한 종류를 치료하는데 탁월한 효과가 있음. 이 녀석의 경우에도 ATP-binding site와 함께 그 옆의 Bcl-Abl specific한 부분에까지 binding하여 작용하게 됨.
그 옆에 나와있는 Tarceva는 EGFR receptor에 binding하여 inhibition시키게 되며, NSCLC 치료에 있어 상당히 유용하게 사용되고 있음.
그 옆에 나와있는 것은 Roscovatine으로, 이 경우 CDK2 inhibitor로 개발되어 있음. 다만 이 경우 ATP binding site에 가서 붙다 보니 ATP가 가서 붙어있을 때(c)와 Roscovatine이 가서 붙어있을 때(d)의 구조가 거의 비슷함을 알 수 있음. 이 때문에 이 drug의 경우 CDK2 뿐 아니라 CDK7, CDK9 등도 inhibition한다는 한계점이 있음.
다음 포스트부터는 생화학적 반응의 예시들에 대해 에너지의 관점에서 살펴보도록 하자.
'전공자를 위한 생물학 > 생화학' 카테고리의 다른 글
| [생화학] 12.1 : 생화학 반응의 열역학적 이해 - 2 (0) | 2025.02.28 |
|---|---|
| [생화학] 12.1 : 생화학 반응의 열역학적 이해 - 1 (0) | 2025.02.27 |
| [생화학] 11.4 : gated ion channel (0) | 2024.11.28 |
| [생화학] 11.3 : RTK(receptor tyrosine kinase) - 2 (0) | 2024.11.28 |
| [생화학] 11.3 : RTK(receptor tyrosine kinase) - 1 (0) | 2024.11.17 |