이번 포스트에서는 진핵생물에서 일어나는 전사인자(transcription factor)들의 조절 과정에 대해 알아보도록 하자.
transcription factor 그 자체도 regulation을 받을수 있음. 이 factor들은 기본적으로 단백질이기에 흔히 phosphorylation, ubiquitylation, sumoylation, methylation, acetylation 등의 post-translational modification(PTM)에 의해 activity가 modulate될 수 있음.
phosphorylation의 경우 Ser, Thr, Tyr 등의 amino acid, 그 중에서도 특히 OH 부분에 phosphate가 붙는 현상을 의미함. phosphorylation이 일어나게 되면 중성이었던 OH에 -2가의 인간기가 붙게 되므로 dramatic한 charge change가 발생하게 되고, 이 때문에 대규모의 단백질 구조변화가 유발될수도 있음.
ubiquitylation은 lys residue와 같은 곳에 ubiquitin이 가서 붙는 현상을 의미함. (이 때 ubiquitin은 평균적으로 약 80개의 amino acid로 이루어진 작은 단백질임) ubiquitylation이 일어나게 되면 가장 일반적으로는 proteolysis에 의한 destruction이 유발될 수 있고, 이 밖에 ubiquitin이 붙어서 오히려 activity가 stimulation되는 경우도 있음.
보통은 monoubiquitylation(하나의 ubiquitin이 붙음)에 의해 activator 등의 활성이 stimulation되는 경우가 많으며, polyubiquitylation(여러 ubiquitin이 붙음)이 일어나면 대부분 protein destruction이 촉진됨. (참고로 대부분의 proteasome들은 단백질을 분해하는 역할만을 충실히 수행하지만, proteasome 중 일부인 19S regulatory particle(일반적으로 regulatory particle이 ubiquitin을 인식함)은 monoubiquitylation의 결과물을 인식한 후 전사를 촉진시키는 역할을 하기도 한다는 사실이 알려져 있음)
sumoylation은 polypeptide에 SUMO(Small Ubiquitin-related Modifier)라는 단백질이 붙는 현상을 의미함. (이 녀석의 이름 중에 ubiquitin이 들어가 있기는 하지만 sumoylation은 단백질 분해와는 관련이 없음) SUMO라는 단백질이 붙으면 polypeptide의 location이 바뀜. 이에 따라 원래 특정 위치에서 열심히 기능을 하고 있었던 polypeptide가 sumoylation에 의한 location 이동에 의해 제 기능을 못하게 되는 등의 일이 가능함.
가장 대표적으로 sumoylation되는 분자들이 activator이며, sumoylated activator는 특정한 nuclear compartment에 가게 되고, 그 결과 gene으로부터 멀어지게 되므로 결과적으로 activator가 gene을 활성화시킬 수 없게 됨.
참고로 activator에 acetylation이 일어날 수도 있으며, acetylated activator는 도리어 활성화될수도, 불활성화될 수도 있음. (nonhistone activator와 repressor들도 HAT[histone acetyltransferase]에 의해 acetylation될 수 있음)
coactivator
coactivator는 activator의 역할을 돕는 모든 단백질군을 지칭함. (즉, activator와 general transcription factor 등의 interaction을 mediate해줌) 참고로 coactivator의 일부는 mediator로도 불림.
물론 모든 activator가 coactivator를 필요로 하는 것은 아니지만 몇몇 activator들은 coactivator들의 도움을 받아 전사를 activation함.
그렇다면 coactivator의 정체는 어떻게 알게 되었을까. coactivator의 존재는 activator interference라는 현상을 관측하다가 알게 됨. 실험 컨셉을 간단히만 알아보자. 우선 두 개의 activator와 각 activator에 의해 활성화되는 gene들을 넣어준 뒤 transcription activity 정도를 측정해봄.
이 때 둘 중 하나의 activator 양을 나머지 하나에 비해 엄청나게 많이 넣어주면 다른 한 종류의 activator에 의한 transcription activity는 엄청나게 낮아짐. 이 실험 결과를 보면 양이 많아진 activator가 activation에 필요한 무언가를 다 가져가버려서 이런 현상이 발생했을 것이라는 합리적 의심이 가능함. 결과적으로 이 무언가가 coactivator임.
이제 coactivator와 관련된 실험 결과를 살펴보자.

위 그림에 나타난 실험은 앞서 관찰한 activator interference 현상에서, 실제로 coactivator에 의해 그런 결과가 나왔다면 coactivator 양을 증가시켜줄 시 다시금 transcription이 activation될 것이라는 생각 바탕으로 수행한 것임.
참고로 이 때 넣어준 mediator는 coactivator의 일종이고, GAL4-Vp16은 activator의 일종임. (GAL4의 DNA-binding domain, Vp16의 transcription-activating domain을 fusion) 그 결과 당연히 GAL4-Vp16을 넣어주지 않은 sample에서는 mediator 양과 상관없이 전사가 촉진되지 않은 반면, GAL4-Vp16이 있는 조건하에서는 mediator를 많이 넣어주면 많이 넣어줄수록 transcription activity가 점차 높아짐. 참고로 (a)로부터 알아낸 경향성을 그래프 형태로 다시금 표현한 것이 (b)임.
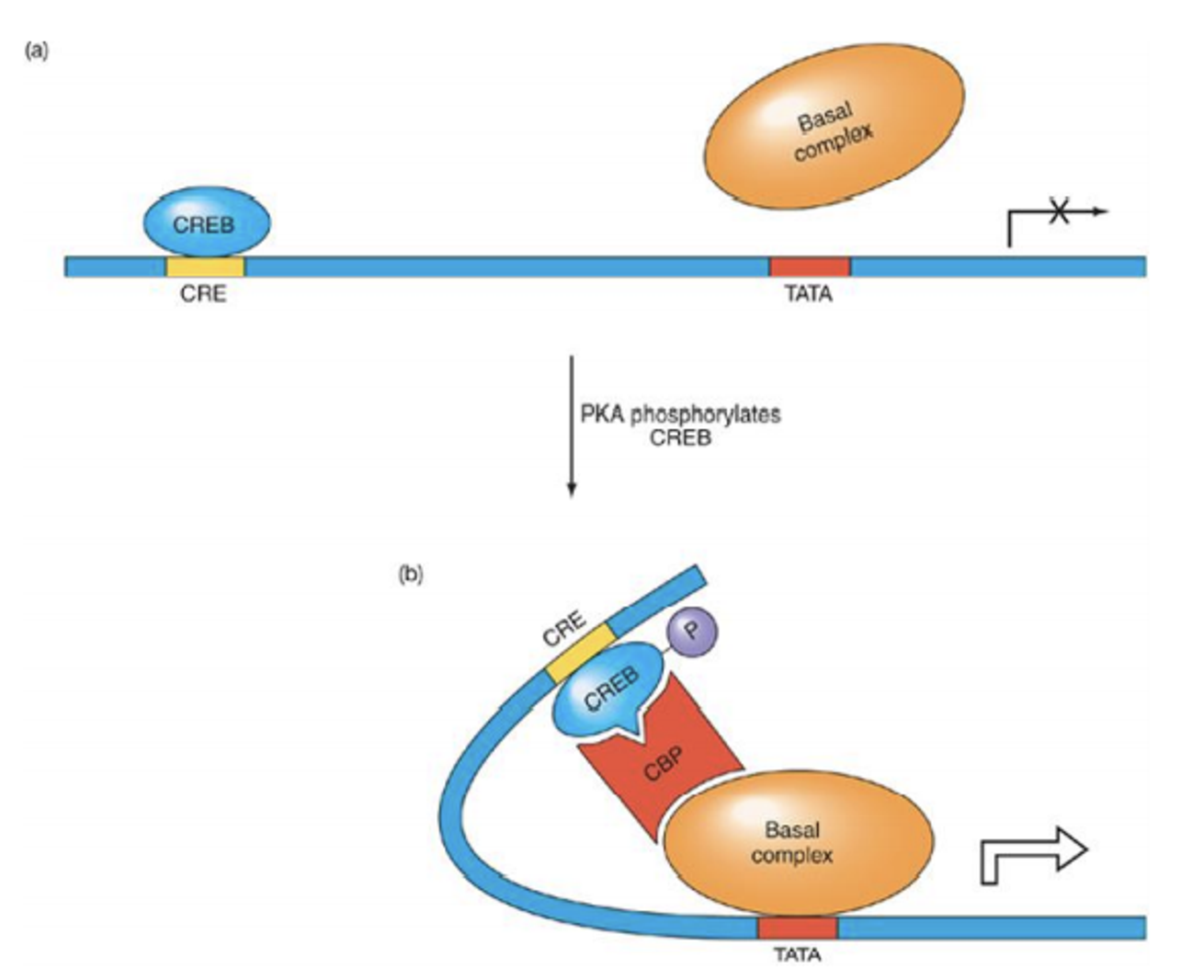
위 그림은 coactivator의 한 예를 보여주고 있음. (참고로 이 때 CRE는 cAMP responsive element, CREB은 CRE-binding protein, CBP는 CREB-binding protein, PKA는 protein kinase A임)
보면 (a)에서 나타난 것처럼 CRE라는 DNA element에 CREB이라는 activator가 붙어있더라도 그 자체만으로는 전사의 활성화가 일어나지 못함. 그런데 만약 signaling pathway에 의해 PKA가 활성화된다면, PKA가 CREB을 인산화시켜 CREB으로 하여금 구조적으로 변하게 만들어줌. 그러면 CREB은 coactivator의 일종인 CBP와 결합할 수 있게 되고, 그 결과 (b)에서 나타나는 것과 같이 여러 transcription element들이 recruit되어 전사가 활성화됨.
한편 nuclear receptor I, II의 작용 과정에서도 coactivator가 등장함. (III의 경우 애초에 아직 orphan receptor이므로 coactivator가 작용하는지 여부를 논할 수 없음)
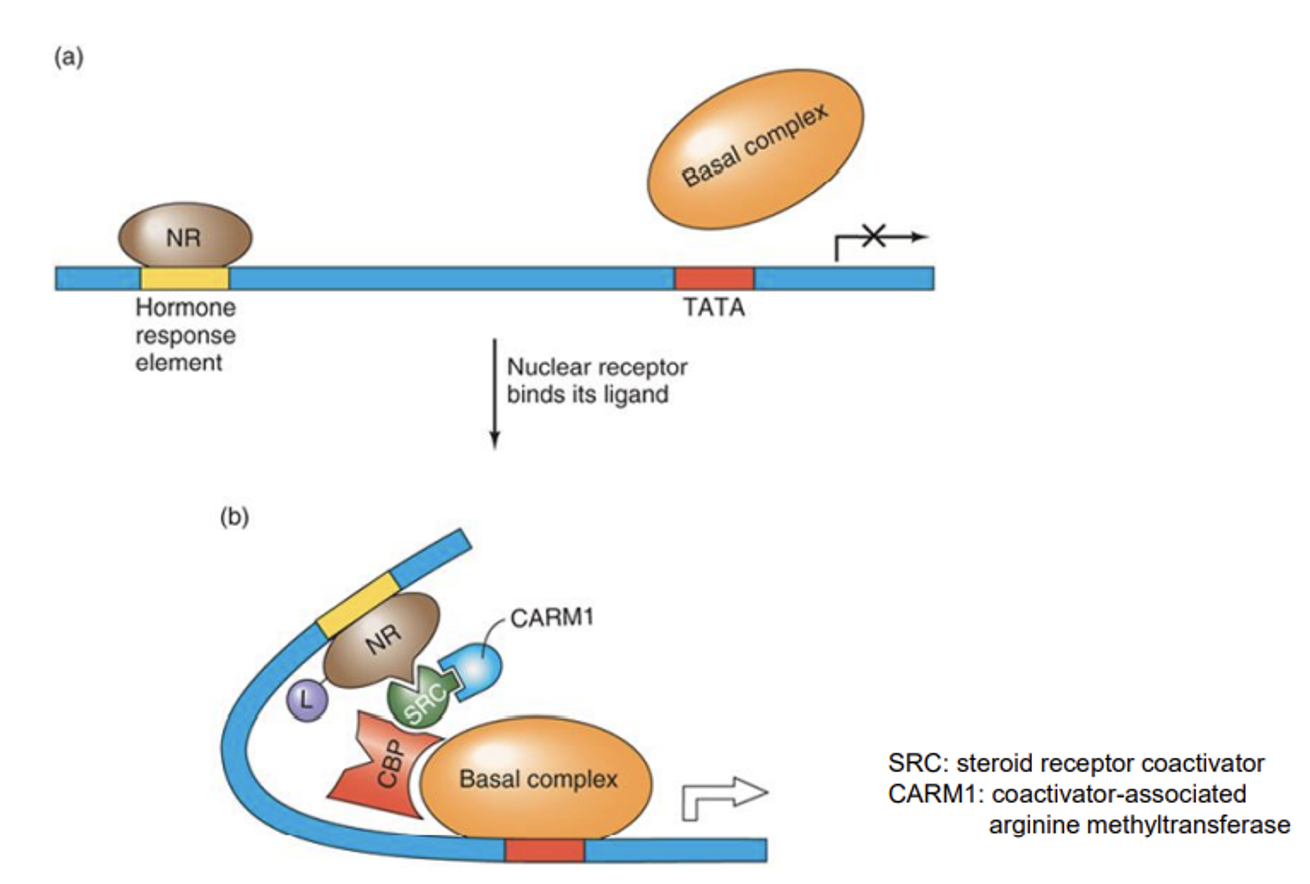
위 그림은 특히 nuclear receptor II의 작용 과정을 묘사하고 있음. 보면 ligand가 존재하지 않을 때는 (a)와 같이 NR이 hormone response element에 붙어있기는 하나, 이 때는 NR이 전사를 repression시켜주고 있음. 그러다가 ligand L이 들어오게 되면 NR-L complex가 형성되고, 그 결과 (b)와 같이 SRC(steroid receptor coactivator)라는 coactivator가 결합하고, 이 SRC에 CBP가 binding되어 결과적으로 basal complex가 recruit됨.
이 밖에 SRC에 의해 CARM1(coactivator-associated arginine methyltransferease)라는 녀석이 recruit되고, 이 녀석이 특정 protein의 arginine residue에 methylation을 유발해 다른 방식으로 전사를 activation시키기도 함.
2023.12.17 - [전공자를 위한 생물학/분자생물학] - [분자생물학] 12.2 : DNA-binding motif의 구조 - 1
[분자생물학] 12.2 : DNA-binding motif의 구조 - 1
이번 글에서는 activator의 구성 요소 중 하나인 DNA-binding motif들의 구조에 대해 알아보자. DNA-binding domain은 꽤나 정형화되어 있고, activator를 비롯한 여러 transcription factor에서 꽤나 공통적으로 발견
unicellular.tistory.com
nuclear receptor와 관련된 보다 자세한 내용은 위 포스트를 참고할 것.
signal transduction pathways
앞서 살펴본 것과 같은 activator의 modification 등을 유발하는 대표적인 경로가 바로 signal transduction pathway임.
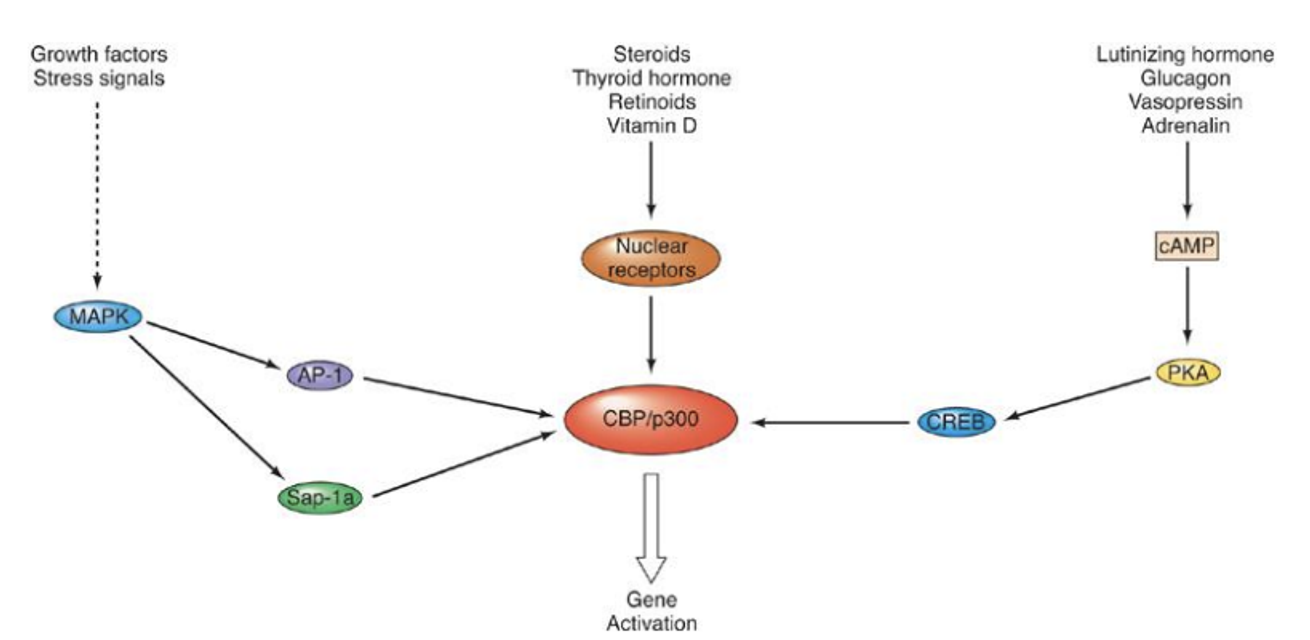
앞서 살펴봤던 CBP(혹은 p300이라고도 부름)라는 coactivator를 activation시키는 다양한 signal transduction pathway가 존재함. 위 그림에서는 그 중 3가지 pathway를 나타내주고 있음.
이 중에서 특히 Ras와 Raf signal transduction pathway에 대해 조금 더 자세히 알아보자.
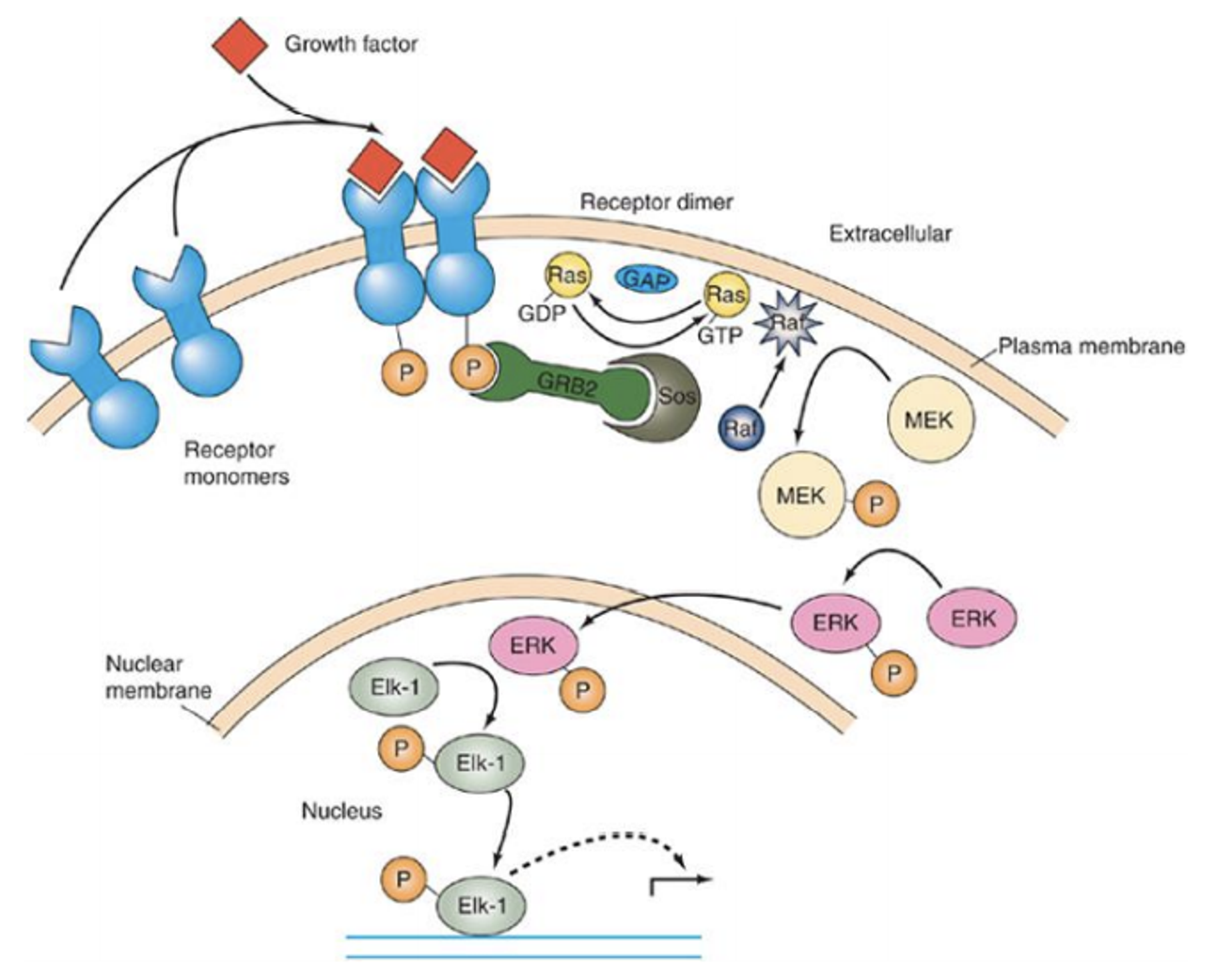
하나하나 살펴보자.
monomer로 존재하고 있던 receptor에 growth factor가 붙으면 receptor들은 dimer를 형성하게 되고, 서로의 tyrosine residue를 인산화시키게 됨. 이렇게 형성된 phosphotyrosine residue를 GRB2 내의 SH2 domain이 인지해 결합하게 되고, 이어서 GRB2를 인지하고 SOS라는 녀석이 결합하게 됨.
SOS는 막에 존재하는 Ras라는 protein에 원래 붙어있던 GDP를 GTP로 바꿔주게 되고, 그 결과 Ras는 활성화됨. (참고로 Ras는 lipid bilayer에 anchored되어 있는데, 단백질 합성 후 PTM 과정에서 lipid tail을 달아주게 되면 Ras와 같이 anchored되어있는 protein들을 만들 수 있음) 활성화된 Ras는 Raf를 세포막 주위로 recruit한 뒤 activation시킴. 이렇게 활성화된 Raf는 인산화 활성을 가지게 되고 (특히 serine residue를 인산화) 그 결과 MEK을 인산화시키게 됨.
이후 인산화된 MEK은 ERK를 인산화하게 되고, 인산화된 ERK는 핵 안으로 들어가 여타 다른 단백질들을 인산화시켜 결과적으로 전사 조절이 일어나게 됨.
이런 pathway에서 중요한 점은 signal amplification이 일어날 수 있다는 것임. 위 pathway상에서는 대략 SOS의 recruit 이후부터의 signal들이 주로 amplification될 것임. (결과적으로 소수의 input이 매우 강한 전사 조절을 유발할 수 있게 됨)
다음 포스트부터는 chromatin(염색질)의 구조가 전사에 미치는 영향에 대해 알아보도록 하자.
'전공자를 위한 생물학 > 분자생물학' 카테고리의 다른 글
| [분자생물학] 13.2 : chromatin의 응축화 - 1 (0) | 2023.12.18 |
|---|---|
| [분자생물학] 13.1 : chromatin의 기본 구조 및 histone (0) | 2023.12.18 |
| [분자생물학] 12.6 : insulator (0) | 2023.12.18 |
| [분자생물학] 12.5 : transcription factory, complex enhancers, etc (0) | 2023.12.17 |
| [분자생물학] 12.4 : activator들간의 상호작용 (0) | 2023.12.17 |