웨스턴 블롯은 세포 내 단백질의 존재 유무를 파악하거나, 존재량을 정량하는데 있어서 가장 많이 사용되는 기본적인 실험방법 중 하나에요. 이번 시리즈에서는 웨스턴 블롯에 대한 기본적인 원리, 단계, 그리고 응용에 대해 자세히 알아보도록 할게요.
Western blot의 단계
“블롯팅(blotting)”이라는 용어는 생물학적 샘플을 젤(gel)에서 막(membrane)으로 옮긴 후, 막 표면에서 이를 검출하는 과정을 의미해요. 웨스턴 블롯(Western blot) 실험 또는 웨스턴 블롯팅(또는 항체를 사용하여 특정 항원을 검출하기 때문에 immunoblot이라 불리기도 함)은 1979년 Towbin 등의 연구자들에 의해 처음 소개되었고, 이제는 단백질 분석에서 흔히 사용되는 기본 실험기법이 되었어요. 웨스턴 블롯을 이용하면 목표 단백질에 대한 질적 및 반정량적(qualitative and semi-quantitative) 데이터를 생성할 수 있죠.

웨스턴 블롯팅 절차의 첫 번째 단계는 샘플에 있는 고분자들을 젤 전기영동(gel electrophoresis)을 통해 분리하는 거예요. 이후 분리된 분자들은 일반적으로 니트로셀룰로스(nitrocellulose) 또는 폴리비닐리덴 디플루오라이드(polyvinylidene difluoride, PVDF) 막으로 옮겨져요. 다음으로는 항체가 막 표면에 비특이적으로 결합하지 않도록 막을 블로킹(blocking) 처리해요. 그런 다음, 막에 전이된 단백질을 특정 단백질에 결합하는 항체(1차 항체, primary antibody)와 1차 항체의 호스트 종에 특이적인 항체(2차 항체, secondary antibody) 조합으로 탐침(probe)합니다. 종종 2차 항체는 효소와 결합되어 있으며, 적절한 기질(substrate)과 함께 사용할 경우, 검출 가능한 신호를 생성해요.
크로모제닉 기질(chromogenic substrate)은 막에 침전물을 형성해 색상 변화를 유도하며 눈으로도 확인할 수 있어요. 가장 민감한 검출 방법은 발광화학적 기질(chemiluminescent substrate)을 사용하는데, 항체에 결합된 효소와의 반응으로 생성되는 부산물로 빛이 나와요. 빛 출력은 필름(film)을 사용해 포착할 수 있으며, 요즘은 화학 발광 신호를 CCD 카메라(charge-coupled device, CCD)를 기반으로 한 디지털 이미지 장비가 필름을 대체하는 대중적인 방법으로 사용되고 있어요. 또는 형광 표지된 항체(fluorescently tagged antibody)를 사용할 수도 있으며, 형광 신호를 포착할 수 있는 장비가 필요하죠. 형광 블롯팅(fluorescent blotting)은 비교적 새로운 기술로, 단일 블롯에서 여러 단백질을 동시에 검출할 수 있는 멀티플렉스(multiplex)의 가능성을 제공하여 인기를 끌고 있어요.
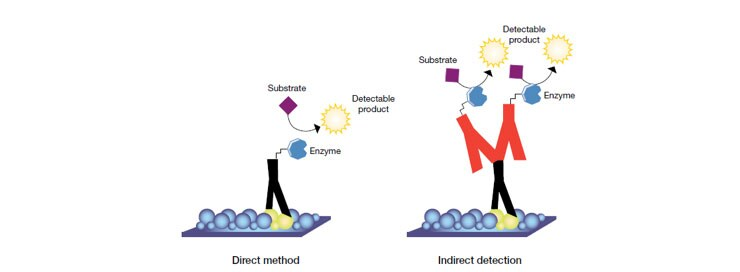
웨스턴 블롯 실험의 검출 단계에서는 다양한 절차가 사용되며, 가장 흔한 변형 중 하나는 위 그림에 나타난 직접 검출(direct detection) 대 간접 검출(indirect detection)의 차이예요. 직접 검출법에서는 항원에 직접 결합된 효소 또는 형광체(fluorophore)로 표지된 1차 항체를 사용해 항원을 검출해요. 이 검출법은 널리 사용되진 않는데, 다양한 이유로 대부분의 연구자들이 간접 검출법을 선호하기 때문이에요. 간접 검출법에서는 먼저 표지되지 않은 1차 항체가 항원에 결합하고, 이후 효소나 형광체로 표지된 2차 항체를 사용해 1차 항체를 검출해요. 이때 사용되는 표지 물질(conjugated molecules)로는 바이오틴(biotin), Invitrogen Alexa Fluor 또는 DyLight 형광체와 같은 형광 탐침(fluorescent probe), 그리고 말초산화효소(horseradish peroxidase, HRP) 또는 알칼리성 인산분해효소(alkaline phosphatase, AP) 같은 효소 결합체가 포함될 수 있어요. 간접법이 직접법보다 가지는 많은 장점에 대해서는 아래에서 설명할게요.
직접(Direct method)
장점
- 한 가지 항체만 필요
- 2차 항체의 비특이적 반응(cross-reactivity)을 없앨 수 있음
단점
- 표지(label)가 목표 단백질과의 결합을 방해할 수 있음
- 항체의 목표 단백질에 대한 특이성이 약하면 배경 신호가 강해질 수 있음
- 표지된 1차 항체의 비용이 많이 들 수 있음
- 표지된 1차 항체 선택 폭이 제한적일 수 있음
간접법(Indirect method)
장점
- 2차 항체에 의한 신호 증폭(signal amplification)이 가능함
- 표지된 2차 항체의 선택 폭이 넓음
- 하나의 2차 항체로 다양한 1차 항체와 함께 사용할 수 있음
- 2차 항체의 사용은 1차 항체의 목표 단백질 결합을 방해하지 않음
- 표지된 2차 항체를 사용하면 여러 검출 방법을 선택할 수 있는 옵션이 생김
단점
- 비특이적 염색으로 배경 신호가 증가할 수 있음
- 간접법을 사용할 때 추가적인 단계가 필요함
다음 포스트에서는 각각의 과정에 대해 상세히 알아보도록 할게요.
'전공자를 위한 생물학 > 실험' 카테고리의 다른 글
| 유세포 분석(flow cytometry)의 원리, 단계, 응용 - 1 (0) | 2024.10.27 |
|---|---|
| 웨스턴 블롯(Western blot)의 원리, 단계, 응용 - 3 (1) | 2024.10.27 |
| 웨스턴 블롯(Western blot)의 원리, 단계, 응용 - 2 (0) | 2024.10.27 |
| 전기영동(gel electrophoresis)의 원리, 단계, 응용 (0) | 2023.06.23 |
| PCR(중합효소 연쇄반응)의 원리, 단계, 응용 (2) | 2022.03.27 |