[AAV] 1편 : AAV 바이러스란 무엇일까?
유전자를 세포 안에 전달하려면, 안전하면서도 효율적인 '운반 수단'이 필요하죠.
그중에서 가장 많이 활용되는 벡터 중 하나가 바로 AAV(아데노연관바이러스, Adeno-Associated Virus)예요. 작고, 비병원성이고, 세포 특이성이 높다는 점에서 연구자들이 아주 선호하는 바이러스죠.
AAV는 어떤 바이러스인가요?
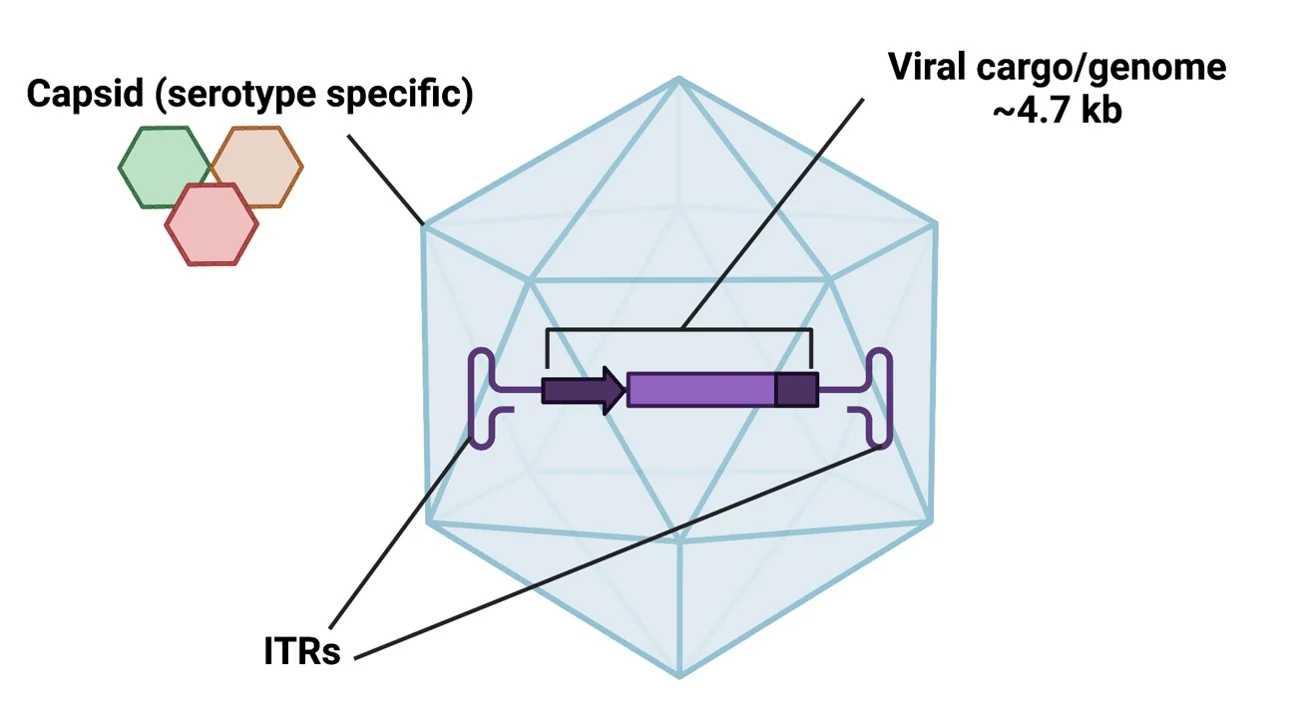
AAV는 Parvoviridae 계열의 단일 가닥 DNA 바이러스예요. 외피(envelope)가 없는 정이십면체 모양의 단백질 캡시드에 유전자가 들어 있어요. 이 바이러스는 사람을 포함한 숙주에게 병을 일으키지 않고, 또한 자체적으로는 복제할 수 없는 특이한 바이러스죠.
이 특징 덕분에, 실험실에서는 AAV의 내부 유전자를 제거하고 그 자리에 우리가 넣고 싶은 유전자(cDNA, CRISPR gRNA, SaCas9 등)를 넣어서 사용해요. 이런 형태를 recombinant AAV(rAAV)라고 불러요.
왜 AAV가 특별할까요?
AAV의 장점은 다음과 같아요:
비병원성
사람에게 감염을 일으키지 않아요.
유전체 통합이 거의 없음
AAV는 감염된 세포의 DNA에 유전자를 삽입하지 않고, 에피좀(episome) 상태로 머물기 때문에, 삽입 돌연변이 위험이 낮아요.
비분열 세포에서도 발현
신경세포처럼 분열하지 않는 세포에서도 유전자가 잘 발현돼요.
세포 특이성 조절 가능
AAV의 외부 캡시드 단백질을 교체하면 특정 세포에만 감염되도록 조절할 수 있어요.
긴 발현 지속 기간
일부 조직에서는 수개월~수년까지 발현이 유지될 수 있어요.
AAV 벡터는 어떻게 구성돼 있을까요?
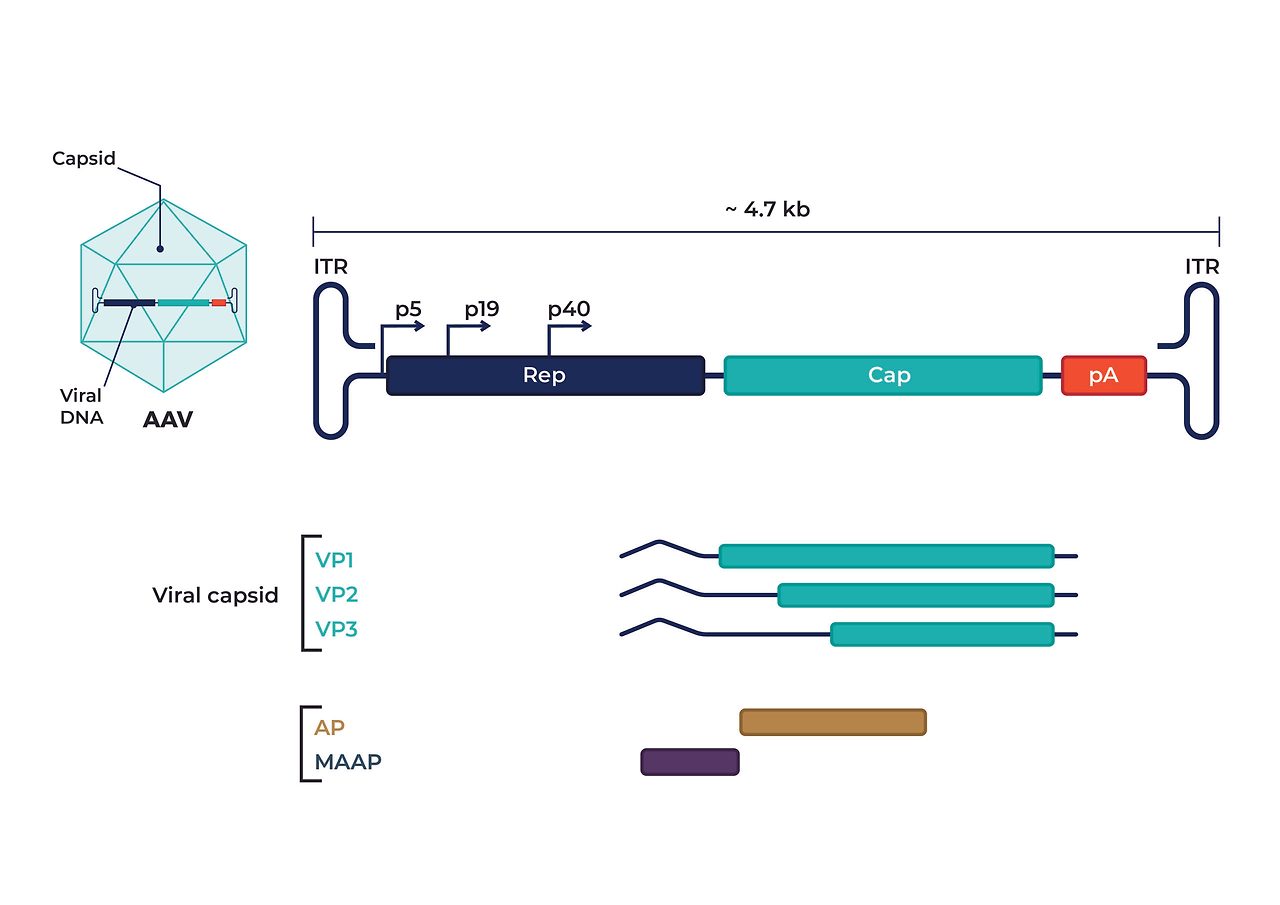
연구에 사용되는 rAAV는 원래 AAV 유전자를 대부분 제거하고, ITR(Inverted Terminal Repeat)이라는 반복 서열만 남겨요. 이 ITR은 바이러스 패키징과 발현에 꼭 필요하죠.
AAV의 용량은 약 4.7 kb까지예요. 그 이상 크기의 유전자를 넣으려면 두 개 이상의 AAV 벡터를 함께 감염(co-infection)시켜야 해요.
반대로, 아주 작은 유전자를 넣고 빠른 발현을 원한다면 self-complementary AAV (scAAV)를 선택할 수도 있어요. 이 방식은 바이러스 안의 DNA가 스스로 접혀서 이중가닥이 되기 때문에, 발현이 더 빨라지죠.
감염된 세포에서 언제부터 유전자가 발현될까요?
AAV는 세포 안에서 감염된 후, 숙주의 기전을 이용해 이중가닥 DNA로 바뀌어야 유전자 발현이 시작돼요. 이 과정에 시간이 필요해서, 보통 1~2주 뒤부터 안정적인 발현이 시작돼요.
하지만 한 번 발현되기 시작하면, 분열하지 않는 세포에서는 아주 오랫동안 유지될 수 있어요. 반면, 세포 분열이 활발한 조직에서는 AAV가 세포분열과 함께 사라지기 때문에 발현이 점점 줄어들 수 있어요.
AAV는 구조도 단순하고, 특성도 유익해서 신경과학, 유전자 편집, 광유전학(optogenetics), 화학유전학(chemogenetics) 등 다양한 분야에서 활용되고 있어요. 다음 편에서는 이 AAV를 만들기 위한 핵심 요소, 즉 AAV 플라스미드 구성과 유전자 디자인에 대해 자세히 소개할게요.