[렌티바이러스] 2편 : 2세대 vs 3세대 렌티바이러스 시스템
렌티바이러스 벡터는 시간이 흐르면서 더 안전하고 효율적으로 진화해왔어요. 그 결과, 현재는 주로 2세대(second-generation)와 3세대(third-generation) 시스템이 사용되고 있죠.
실험에 앞서 어떤 시스템이 더 적합한지 판단하려면, 각 세대의 구성과 특징을 잘 이해해야 해요.
2세대 시스템, 간단하고 역가 높은 구성
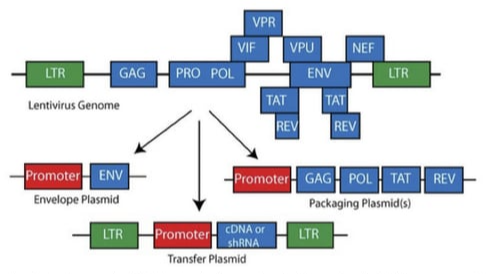
2세대 시스템은 기본적으로 3개의 플라스미드로 구성돼요. 하나는 목적 유전자가 들어 있는 전달 플라스미드, 두 번째는 외피 단백질을 발현시키는 외피 플라스미드, 마지막 하나는 Gag, Pol, Rev, Tat 유전자가 통합되어 있는 패키징 플라스미드예요.
이 시스템의 가장 큰 장점은 구성이 단순하고 바이러스 생산 효율이 높다는 점이에요. 실험실에서 많이 쓰는 293T 세포에 트랜스펙션만 하면, 비교적 쉽게 고역가(high titer)의 렌티바이러스 입자를 얻을 수 있어요. 그래서 CRISPR 도입, 안정적 세포주 생성, 단기 감염 실험 등 다양한 연구에 널리 사용돼요.
하지만 구조가 단순한 만큼 바이러스가 스스로 복제할 가능성(recombination risk)이 이론적으로 존재해요. 즉, 패키징 플라스미드와 전달 플라스미드 사이에 재조합이 일어나면, 복제 가능한 바이러스가 생길 수 있다는 우려가 있는 거죠. 물론 실험실 수준에서는 매우 드물지만, 특히 생체 내 실험이나 임상 전 단계 연구에서는 이 점이 걱정될 수 있어요.
3세대 시스템, 안전성을 우선으로 설계된 구조

이런 우려를 최소화하기 위해 개발된 게 바로 3세대 시스템이에요. 3세대는 2세대보다 구성은 좀 더 복잡하지만, 그만큼 바이러스 재조합 가능성을 더욱 줄여 안전성을 높였어요.
가장 큰 차이점은 패키징 시스템을 Rev와 Gag/Pol로 나눠서 두 개의 플라스미드로 분리했다는 점이에요. 이렇게 나누면 바이러스가 스스로 복제되려면 더 많은 재조합이 동시에 일어나야 해서, 위험성이 크게 줄어요.
또 하나의 중요한 변화는 Tat 유전자가 아예 제거되었다는 점이에요. 대신 Tat이 없어도 작동할 수 있도록 5' LTR 부위에 Tat-independent promoter가 추가됐어요. 이로써 바이러스 생산이 Tat 없이도 가능해졌고, 또 하나의 안정성 장치가 더해졌어요.
결과적으로 3세대 시스템은 복제 가능한 바이러스 생성 위험이 극히 낮은 구조로, 생체 내 전달 실험, 바이오의약품 개발, 유전자 치료 전임상 등 고안전성이 요구되는 환경에서 많이 활용되고 있어요.
효율 vs 안전, 어떤 걸 우선해야 할까요?
2세대 시스템은 효율성 면에서 더 유리해요. 플라스미드 수가 적고, 트랜스펙션이 간단하며, 고역가 바이러스 생산이 용이하거든요. 반면 3세대 시스템은 플라스미드가 4개나 돼서 작업이 다소 번거롭고, 경우에 따라선 바이러스 역가도 조금 낮게 나올 수 있어요. 하지만 안전성 면에서는 확실한 우위가 있어요.
그래서 실험 목적에 따라 적절한 시스템을 선택하는 게 중요해요. 단순한 in vitro 감염 실험이라면 2세대로도 충분하지만, 생체 내 감염, 장기 유전자 발현, 임상 응용을 염두에 둔다면 3세대 시스템이 훨씬 적합해요.
다음 편에서는 이렇게 진화한 렌티바이러스 벡터가 실험실에서 어떻게 활용되고 있는지, 그리고 임상 현장에서는 어떤 성과를 거두고 있는지 실전 중심으로 소개해드릴게요.