[생화학] 10.1 : 세포막(cell membrane) - 3
이번 포스트에서는 막단백질에 대해 알아보자.
membrane protein들은 receptor로 작용할 수도 있고, channel, gate, pump로 작용할 수도 있으며, enzyme으로 작용할 수도 있음.

일단 membrane protein 중 integral protein은 다시 크게 2가지 종류로 나눌 수 있음. monotopic은 membrane 중 한쪽면만을 바라보고 있는 integral protein을 말하며 polytopic은 membrane 중 양쪽면을 다 바라보고 있는, 막을 관통하는 integral protein을 말함.
peripherial protein은 GPI linked되어있지 않는 membrane protein을 말하며, 이 녀석의 경우 pH change 등의 외부자극에 의해 비교적 쉽게 dissociate될 수 있음. pH 변화 이외에도 high salt를 처리해주거나, chelating reagent를 처리해주거나, mild한 detergent를 처리해주는 식의 방법으로도 이 녀석들을 dissociate시킬 수 있음.
그리고 위 그림 오른쪽에 나타나 있는 amphitropic protein은 원래는 친수성이어서 membrane protein이 아니나 때때로 막과 associate될 수 있는 protein들을 말함. 실제로 위 그림 오른쪽을 보면 amphitropic protein들은 specific한 regulatory event가 있을 때만 막에 link되었다가, 이후 reversible하게 remove되는 것이 가능함. 이 때 amphiptopic protein 중 일부는 GPI-anchored protein의 형태로 존재하기도 하며, 나머지 일부는 PIP에 붙어있기도 함.
참고로 위 그림 왼쪽에 나타나 있는 것처럼 strong detergent를 이용해서 integral membrane protein을 분리할 수 있기도 하며, 이런 방법으로 구조를 알게 된 membrane protein들도 일부 존재하기도 함. 다만 대다수의 membrane protein은 이런 방법만으로 분리해 정제하고 구조를 파악하기 어려움.
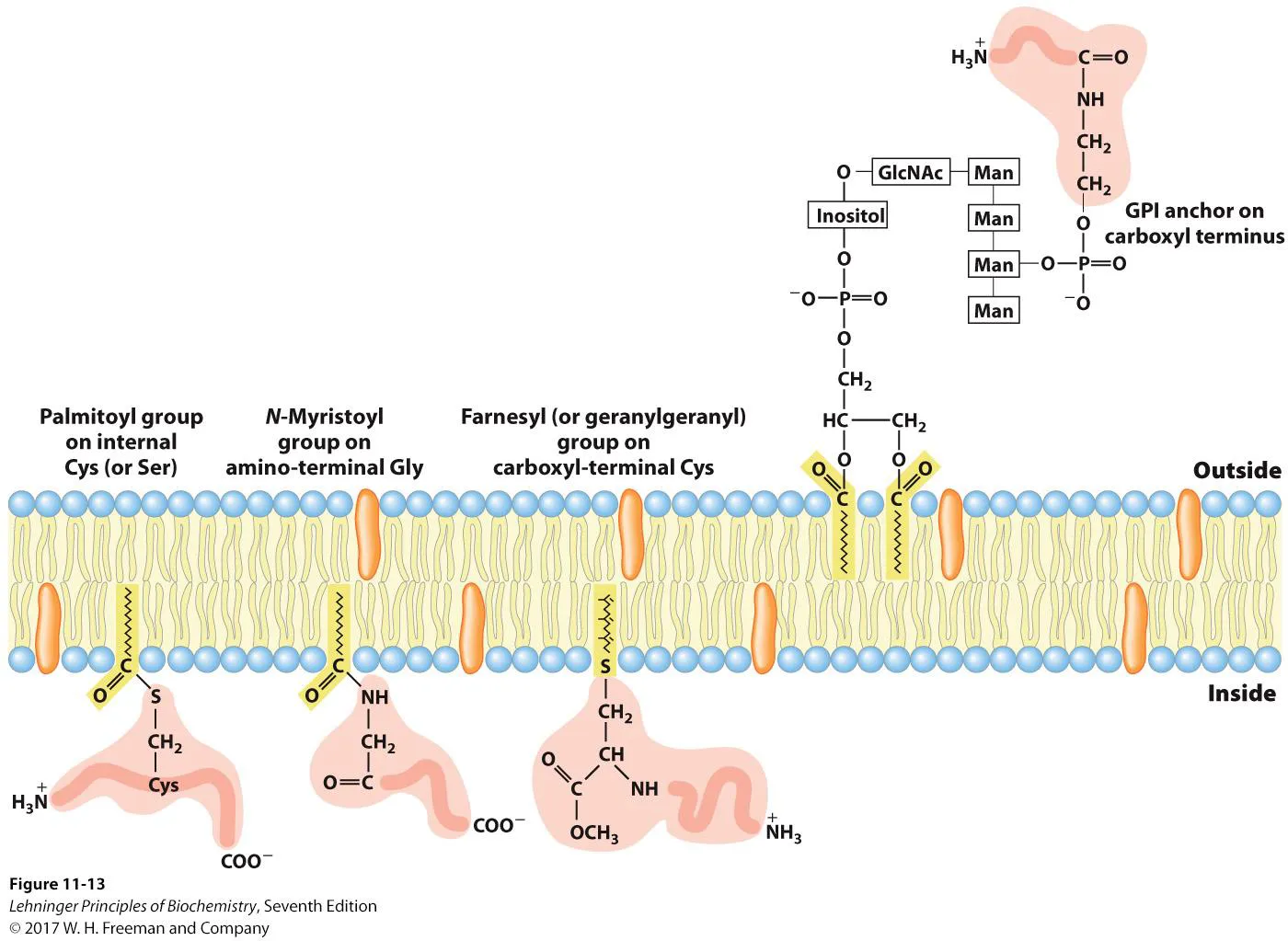
위 그림에는 amphitrophic membrane protein이 나타나 있음. 특히 위 그림 오른쪽 위에 나타나 있는 것은 GPI linker인데, 이 linker는 phosphatidylinositol의 형태에 GlcNAc 1개, 4개의 Mannose가 붙어있는 형태임. 그러다 보니 이 linker를 glycosyl-phosphatidylinositol(GPI)라 부르는 것임. 이 sugar를 매개로 해서 protein의 C terminal에 결합하게 되는데, 더 구체적으로 보면 protein의 Carboxyl end에 sugar 끝에 달린 phoshpoethanolamine이 연결된 형태로 존재하게 됨. 한편 이런 상황에서 phospholipase C, D가 activation되는 signaling이 이루어질 시 이 anchoring protein이 dissociate되는 일이 일어날 수 있음. 참고로 이 때 GPI anchor와 같은 구조는 outer membrane에서만 관찰됨.
그 밖에 위 그림 아래에도 다양한 형태의 amphitrophic membrane protein들이 나타나 있음. 보면 palmitoyl group이 특정 단백질의 Cys과 thioester bond를 이뤄 존재하는 경우, myristoyl group이 protein의 amino terminal에 있는 Gly에 붙어 존재하는 경우, Farnesyl group(isoprene 형태의 lipid)이 단백질 C terminal에 있는 methylated Cys에 연결되어 존재하는 경우가 있음. 이 때 farnesylated protein 중에 Ras라는, 엄청나게 유명한 단백질이 있음. 이 Ras는 상당히 유명한 oncoprotein이어서, 이 녀석에 문제가 생길 시 cancer가 발생할 수 있음. (특히 Ras는 2021년 지금까지도 제대로 정복되지 않은 protein에 해당함)
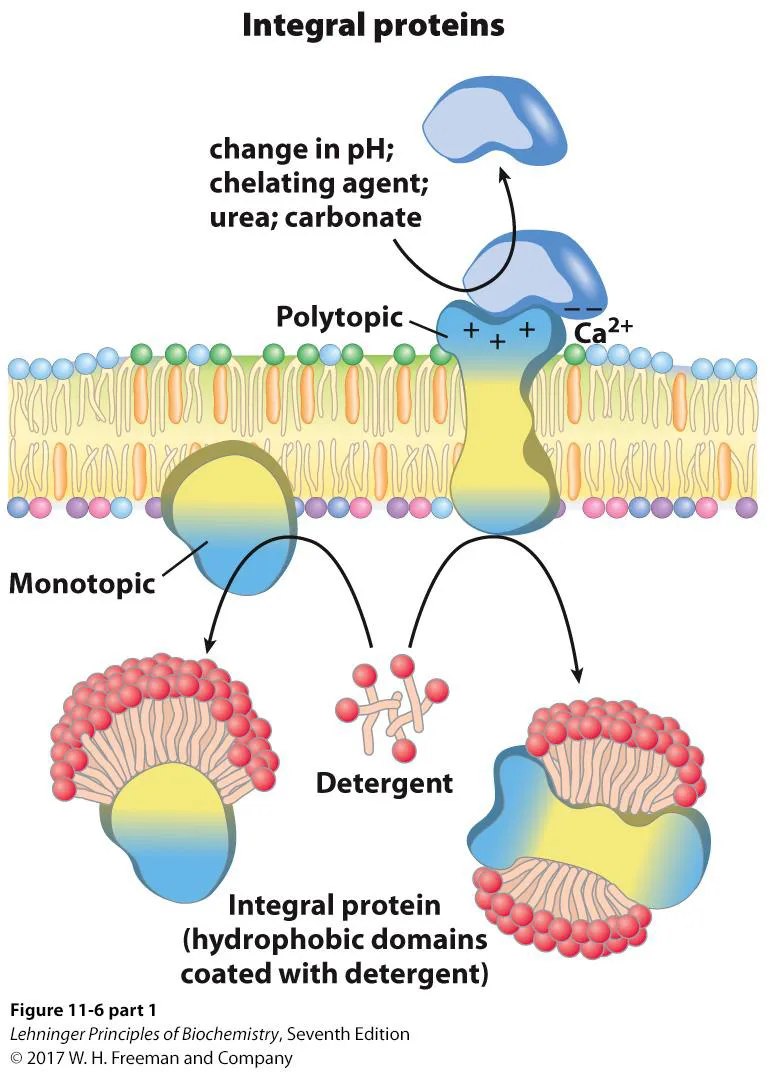
위 그림에는 detergent 등의 condition을 처리해 membrane protein을 isolate하는 과정이 나타나 있음. 이 때 peripheral protein들은 mild한 condition을 가해줘도 dissociate가 되지만 integral protein은 꽤나 strong한 detergent를 사용해줘야 dissociate되는 것이 가능함.
이제 다음으로 integral membrane protein에 대해 알아보자.

위 그림에는 bacteriorhodopsin의 구조가 나타나 있음. 보면 이 녀석은 7번 막을 관통하는 구조임을 알 수 있음. 그리고 이 녀석의 중간부에 앞서 살펴봤었던 retinal이 존재하고 있음.
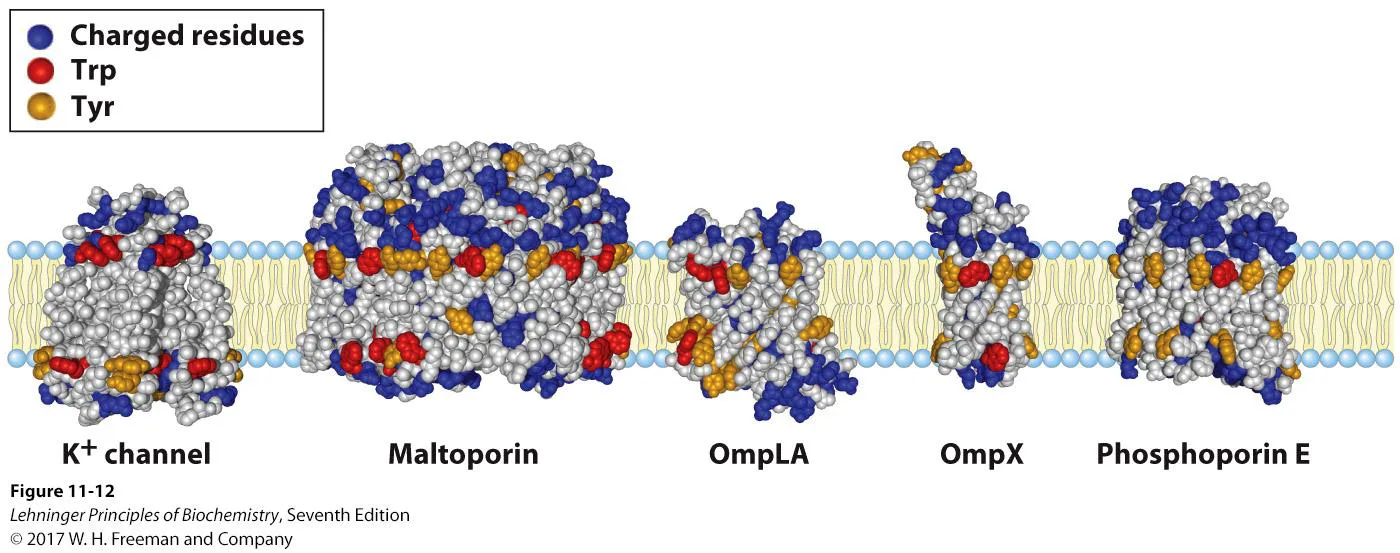
위 그림은 integral protein을 구성하는 각종 amino acid들의 조성을 보여주고 있음. 보면 막을 관통하는 부위에 있는 amino acid들은 대부분 hydrophobic하거나, non-polar한 녀석들임. 한편 물과 접하고 있는 부분에는 charged residue가 많이 존재하고 있음. 그리고 hydrophobic한 부분과 hydrophilic한 부분의 junction에서는 Trp, Tyr과 같은 녀석들이 존재함. 이들은 전체적으로는 bulky hydrophobic한 residue이지만 Trp의 경우 indol의 N이 polar하고 Tyr의 경우에도 hydroxyl한 부분이 polar해질 수 있기 때문에 hydrophobic하면서도 hydrophilic한 부분과 상호작용할 수 있으므로 junction 부위에서 작용할 수 있는 것임.
지금까지 살펴본 integral protein들은 모두 α helix 형태로 membrane을 관통하고 있었음.

그러나 위 그림에서 나타난 바와 같이 막관통 단백질임에도 β-strand가 모인 β-barrel로 이루어져 있을 수도 있음.
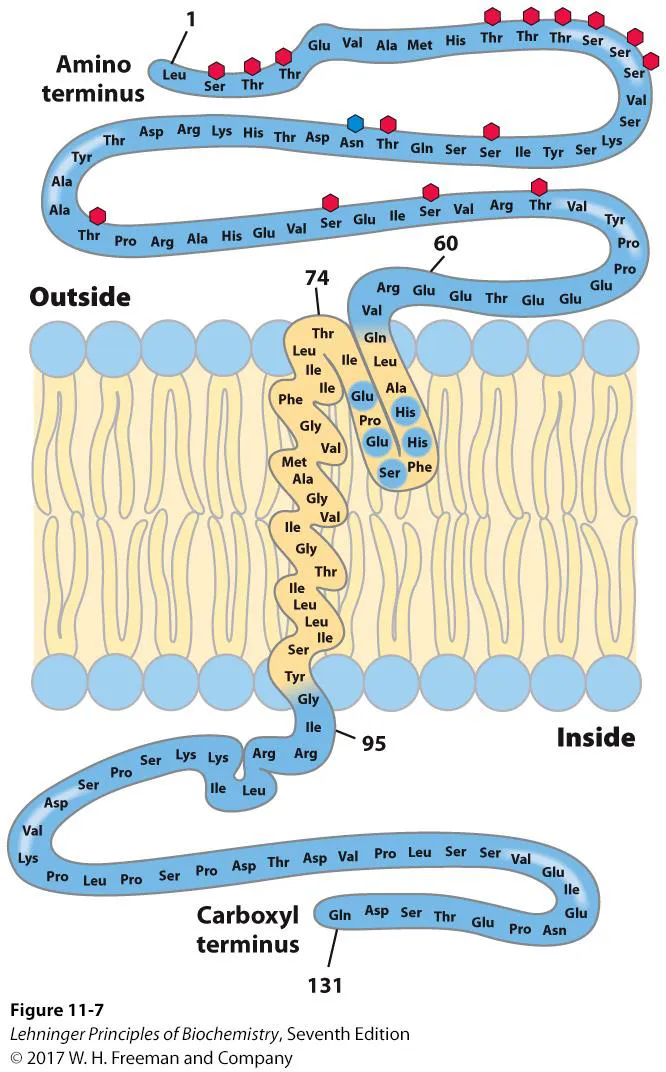
다음으로 위 그림에는 glycophorin의 구조가 나타나 있음. 이 녀석은 single-transmembrane protein의 일종임. 보면 이 녀석은 바깥쪽에만 glycosylation된 채로 존재하고 있음. (앞서 논해봤던 특성임) 한편 가운데 막을 관통하는 부분을 구성하는 amino acid를 보면 거의 다 hydrophobic하다는 것을 알 수 있음. 그리고 membrane을 관통하는 amino acid의 갯수를 세보게 되면 대략 20개 정도의 amino acid가 존재함을 알 수 있음. 이 때 하나의 amino acid는 1.5옹스트롬 정도의 size를 가지므로, 결국 20개의 amino acid에 의해서 30옹스트롬 정도의 두께를 가지는 plasma membrane을 관통할 수 있게 되는 것임.
실제로, 특정 단백질이 transmembrane protein인지, 그리고 transmembrane protein이라면 막을 몇번, 어떻게 관통하는지를 예측하고자 할 경우 water 조건에서 ΔG를 계산하게 됨. 그리고 ΔG를 minimize할 수 있는 구조를 예측하게 됨. 그럴 시 transmembrane protein의 형태를 예측할 수 있음.
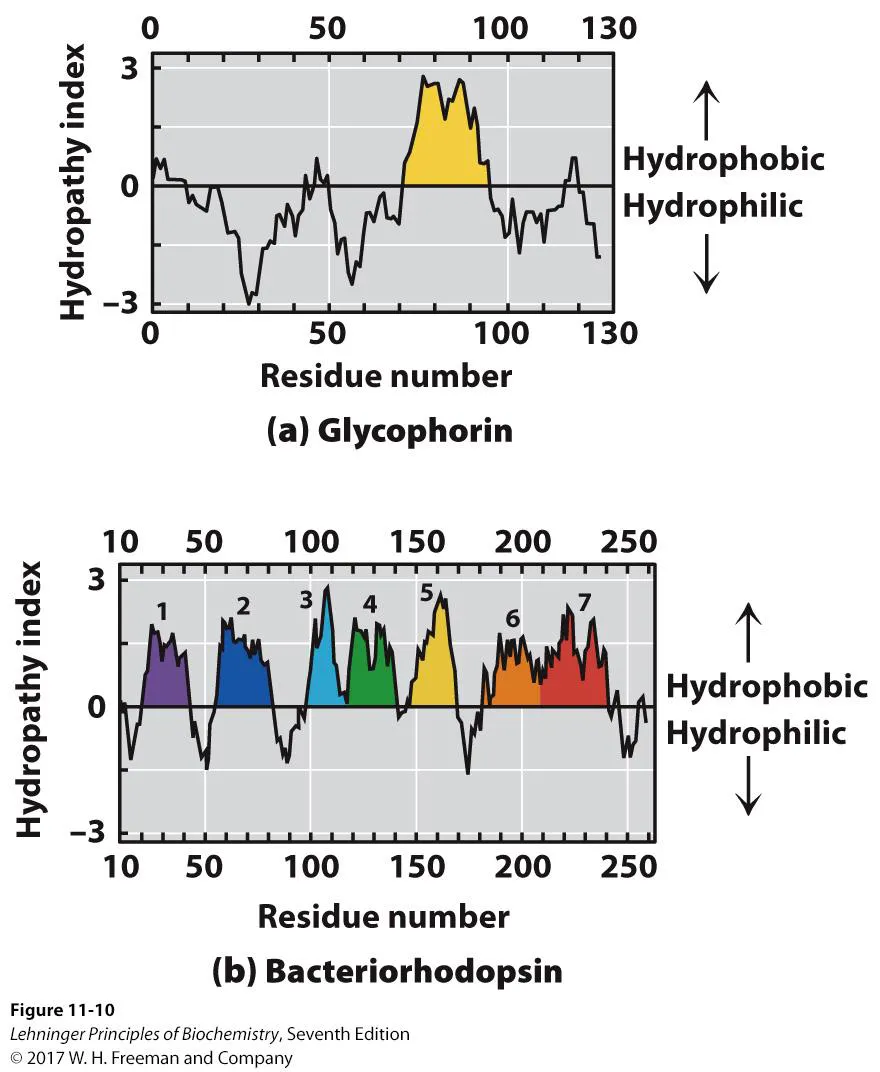
이런 방식으로 얻을 수 있는 대표적인 plot이 위 그림에 나타나 있는 hydropathy plot임. 이 경우 amino acid sequence 각각이 hydrophobic한 정도를 나타내 보여주고 있으며, hydrophobic한 region들의 갯수를 바탕으로 위 그림 위(glycophorin), 아래(bacteriorhodopsin)와 같이 몇 번 막을 관통하는 protein인지를 예측할 수 있음. 참고로 위 그림 (b)에서 6, 7은 그냥 하나의 덩어리로 볼 수도 있지만, 실제로 구조 study를 해 본 결과 이들 region이 각각 한번씩 막을 관통하는 구조를 형성한다는 것을 알게 됨.
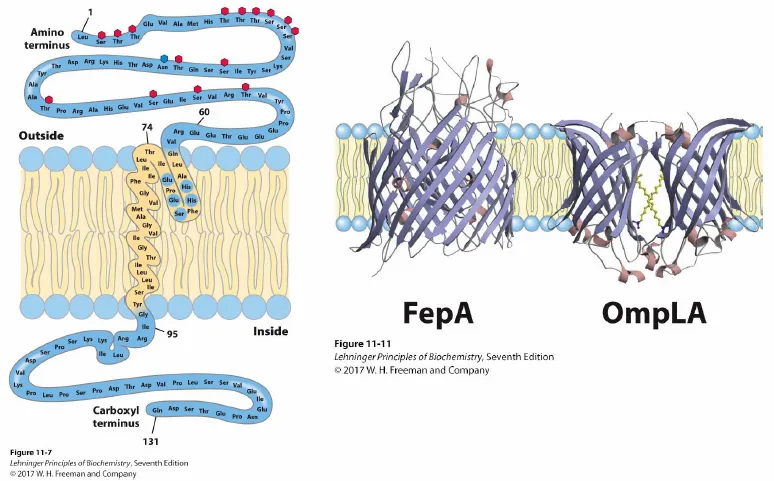
직전에 위 그림 왼쪽과 같은 α helix로 이루어진 transmembrane protein과 위 그림 오른쪽과 같은 β barrel로 이루어진 transmembrane protein에 대해 살펴봤었음. 이 때 α helix가 막을 관통하는 경우 대략 19-20개의 amino acid가 막관통에 필요했음. 그런데 위 그림 오른쪽과 같이 β strand가 막을 통과하는 경우에는 상황이 다름. 실제로 β strand는 α helix에 비해 훨씬 더 늘어진 형태이기 때문에 이런 경우 7-9개의 amino acid만으로도 membrane을 한번 통과하는 것이 가능함.
참고로 \beta strand는 위 그림 오른쪽과 같이 어떤 경우 membrane에 수직하게, 혹은 비스듬하게 배열되어 있음. 그리고 위 그림상에 나온 OmpLA는 2개의 β barrel이 dimer를 이룬 채로 존재하고 있는 녀석이라는 것도 참고삼아 기억해두자.
결국 그렇기에 amino acid sequence를 통해 hydropathy plot을 그릴 때 amino acid를 7-20개씩 잘라서 hydrophobicity를 계산하게 되는 것임. (α helix, 혹은 β strand를 둘 다 고려하는 것) 그 밖에 실제로 구조가 잘 알려진 protein과 어느 정도 비교를 통해 data를 refinement할 수 있었음.
다음 포스트에서는 막의 물리적 특성에 대해 조금 더 알아보자.